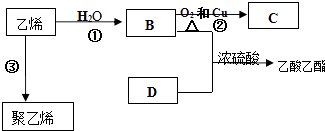
题目内容
【题目】一种可利用含碘废水制取KI的实验流程如下:

回答下列问题:
(1)含碘废水中碘的存在形式一般有I2、I-。检验是否含I2及I-的方法是用CCl4萃取后观察萃取液为紫色,证明含有I2,反复萃取后取水层少许于试管中,_____________。
(2)“制CuI”时,I2被还原为CuI,同时有S4O62-生成。
①该反应的离子方程式为_________________________________________________。
②已知上述反应的平衡常数为1.78×1026,实验中需控制CuSO4过量2%,其目的是_________________。
(3)“制FeI2溶液”的化学方程式为____________________________________;“滤渣3”的成分是________________(填化学式)。
(4)用HI调节溶液pH约为6,其目的是_____________________________________。
(5)准确称取产品0.1000g溶于50mL水,加入适量乙酸并加入曙红钠指示剂,然后用0.025mol·L-1AgNO3溶液滴定,至终点时消耗AgNO3溶液22.00mL,则产品中KI的质量分数为____________(保留三位有效数字)。
【答案】 加入淀粉及FeCl3溶液,观察溶液是否出现蓝色,或加入AgNO3溶液,看是否有黄色沉淀生成 2Cu2++I2+4S2O32-=2CuI↓+2S4O62- 使碘完全转化为CuI 2CuI+Fe=2CuFeI2 FeCO3 除去滤液中过量的K2CO3 91.3%
【解析】(1)检验碘可以用淀粉也可以用四氯化碳萃取,检验I-时为防止碘的干扰,需先充分萃取出碘再在水层中加入淀粉及氧化剂(FeCl3、H2O2及氯水均可),故证明含有I2,反复萃取后取水层少许于试管中,加入淀粉及FeCl3溶液,观察溶液是否出现蓝色,或加入AgNO3溶液,看是否有黄色沉淀生成;(2)①Na2S2O3 是还原剂,转化为Na2S4O6失去2个电子,则反应的离子方程式为:2Cu2++I2+4S2O32-=2CuI↓+2S4O62-;②该反应平衡常数很大,当Cu2+过量时,能使碘完全转化为CuI;(3)依据金属活动顺序表,铁可还原CuI为Cu;制备KI时发生的复分解反应为FeI2+K2CO3=FeCO3↓+2KI,故滤渣为FeCO3;(4)由于沉淀时K2CO3需适当过量,为提高KI纯度,需用HI溶液除去过量的K2CO3;(5)依据滴定反应:Ag++I-=AgI↓,KI的质量分数为:![]() ×100%=
×100%=![]() ×100%=91.3%。
×100%=91.3%。

【题目】如表标出的是元素周期表的一部分元素,回答下列问题:
1 | A | |||||||||||||||||
2 | B | |||||||||||||||||
3 | C | D | E | F | G | H | I | |||||||||||
4 | J | K | ||||||||||||||||
5 | ||||||||||||||||||
6 | ||||||||||||||||||
(1)表中用字母标出的元素中,化学性质最不活泼的是(用元素符号表示,下同),其原子结构示意图为 .
(2)表中用字母标出的元素中,能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的单质与C最高价氧化物的水化物反应的化学方程式 .
(3)在C、D、E形成的氢氧化物中,碱性最强的是(用化学式表示);在F、G、H形成的氢化物中最稳定的是(用化学式表示).
(4)A和B可形成最简单的有机化合物,其结构式为;它的空间构型是 .
(5)在H、K对应的单质中,氧化性较弱的是(用化学式表示).
(6)J元素是过渡元素铁,工业上常用赤铁矿(主要成分为Fe2O3)为原料,采用高炉炼铁的方式炼铁,其原理是,把赤铁矿、焦碳和石灰石一起加入高炉,在高温下,把铁从赤铁矿中还原出来,写出该反应的化学方程式 .