题目内容
16.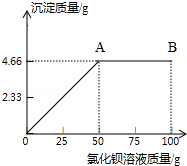 现将4克氯化钠和硫酸钠的混合物加入到50.66克水中,形成溶液.再向其中逐滴滴入氯化钡溶液.产生沉淀的质量与滴入氯化钡溶液的质量关系如图所示:
现将4克氯化钠和硫酸钠的混合物加入到50.66克水中,形成溶液.再向其中逐滴滴入氯化钡溶液.产生沉淀的质量与滴入氯化钡溶液的质量关系如图所示:(1)求混合物中硫酸钠的质量分数.
(2)求恰好完全反应时,所得溶液中溶质的质量分数.
分析 氯化钠和硫酸钠的混合物中硫酸钠与氯化钡反应生成硫酸钡沉淀和氯化钠,而混合物中的摧毁化钠不能与氯化钡反应;因此由生成沉淀硫酸的质量可计算出混合物中硫酸钠的质量和反应生成氯化钠的质量;
由反应的质量关系图,当加入50g氯化钡溶液时恰好完全反应形成4.66g硫酸钡沉淀,此时所得溶液为氯化钠溶液,原混合物中氯化钠质量和反应生成氯化钠质量和与反应后所得溶液质量比即为反应后所得溶液的质量分数,据此进行计算.
解答 解:设硫酸钠的质量为x,生成氯化钠的质量为y,
Na2SO4+BaCl2═2NaCl+BaSO4↓
142 117 233
x y 4.66g
则:$\frac{142}{x}$=$\frac{233}{4.66g}$,解得:x=2.84g,
$\frac{117}{y}$=$\frac{233}{4.66g}$,解得:y=2.34g,
(1)混合物中硫酸钠的质量分数为:Na2SO4%=$\frac{2.84g}{4g}$×100%=71%,
答:混合物中硫酸钠的质量分数为71%;
(2)NaCl%=$\frac{4g-2.84g+2.34g}{4g+50.66g+50g-4.66g}$×100%=3.5%,
答:恰好完全反应时,所得溶液中溶质的质量分数为3.5%.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握质量分数的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
6.已知X、Y元素同周期.且电负性X>Y,下列说法一定错误的是( )
| A. | 第一电离能Y小于X | |
| B. | 最高价含氧酸的酸性:X对应的酸的酸性强于Y | |
| C. | 气态氢化物的稳定性:HmY强于HnX | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
7.现有三组溶液:①CCl4和氯化钠溶液;②苯(沸点:80.1℃)和甲苯(沸点:110.6℃)的混合物(苯和甲苯是其他性质非常相似的一对互溶液体);③用四氯化碳提取溴水中的溴单质,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 蒸馏、萃取、分液 | D. | 分液、蒸馏、萃取 |
11.下列除杂方法(括号内为杂质)正确的是( )
| A. | NaCl溶液 (Na2CO3) 加入适量的稀硫酸 | |
| B. | CO2(HCl) 先通过足量的NaOH溶液,再通过浓硫酸干燥 | |
| C. | Cu(CuO) 先加过量的稀硫酸,再过滤 | |
| D. | NaOH溶液(Na2CO3) 加过量的Ba(OH)2溶液 |
1.装置如图,通电后,发现Cu极附近溶液蓝色加深.下列说法正确的是( )
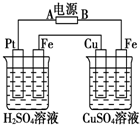

| A. | A极为负极,Cu为阳极 | |
| B. | 左烧杯溶液和右烧杯溶液的pH都变小 | |
| C. | 左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1:1 | |
| D. | 左烧杯溶液浓度变大,右烧杯溶液浓度不变 |
8.下列有关说法正确的是( )
| A. | 加热0.1mol/L Na2CO3溶液时,CO32-的水解程度和溶液的pH均增大 | |
| B. | 100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 | |
| C. | 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,CH3COOH的电离程度和溶液中C(CH3COO-)的值增大 |
5.下列物质中既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al③Al(OH)3 ④Al2O3.
①NaHCO3②Al③Al(OH)3 ④Al2O3.
| A. | ②③ | B. | ③④ | C. | ②③④ | D. | ①②③④ |