题目内容
6.以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做负极,电极反应式为Al-3e+4OH-=2H2O+AlO2-;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5 OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)2.分析 以Mg、Al为电极,以NaOH溶液为电解质溶液构成的原电池中,该条件下,Al易失电子作负极、Mg作正极,负极上Al失电子和OH-反应生成AlO2-;
K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,正极上FeO42-得电子和H2O反应生成Fe(OH)3;负极上Zn失电子和OH-反应生成Zn(OH)2,在正负极得失电子相等的条件下,两个电极反应式相加即得电池反应式.
解答 解:以Mg、Al为电极,以NaOH溶液为电解质溶液构成的原电池中,该条件下,Al易失电子作负极、Mg作正极,负极上Al失电子和OH-反应生成AlO2-,电极反应式为Al-3e+4OH-=2H2O+AlO2-;
K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,正极上FeO42-得电子和H2O反应生成Fe(OH)3,电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5 OH-;
负极上Zn失电子和OH-反应生成Zn(OH)2,在正负极得失电子相等的条件下,两个电极反应式相加即得电池反应式,电池反应式为3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)2,
故答案为:负;Al-3e+4OH-=2H2O+AlO2-;FeO42-+3e-+4H2O=Fe(OH)3+5 OH-;3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)2.
点评 本题考查原电池原理,为高频考点,侧重考查电极反应式的书写,明确正负极上发生的反应是解本题关键,难点是电极反应式的书写,注意:不能根据电极活泼性强弱判断电极正负极,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.NaH中的氢元素为-1价,它可用作生氢剂,反应的化学方程式是NaH+H2O=NaOH+H2↑,则下列说法正确的是( )
| A. | NaOH是氧化产物 | B. | 生成1mol H2反应转移电子数为2NA | ||
| C. | NaH为还原剂 | D. | H2O既是还原剂又是氧化剂 |
1.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol乙烷分子中含有共价键总数为7NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 标准状况下,22.4L苯完全燃烧耗氧分子数为8.5NA | |
| D. | 1 mol丁烷被氯气完全取代时消耗的氯分子数为10NA |
11.反应A(g)+3B(g)═2C(g)+2D(g)在不同情况下测得反应速率,其中反应最快的是( )
| A. | v(A)=0.5mol(L•min) | B. | v(B)=0.9mol(L•min) | C. | v(C)=1.2mol(L•min) | D. | v(D)=0.4mol(L•min) |
15.化学与生活密切相关,下列说法不正确的是( )
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 食盐可作调味剂,也可作食品防腐剂 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |
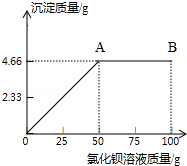 现将4克氯化钠和硫酸钠的混合物加入到50.66克水中,形成溶液.再向其中逐滴滴入氯化钡溶液.产生沉淀的质量与滴入氯化钡溶液的质量关系如图所示:
现将4克氯化钠和硫酸钠的混合物加入到50.66克水中,形成溶液.再向其中逐滴滴入氯化钡溶液.产生沉淀的质量与滴入氯化钡溶液的质量关系如图所示:
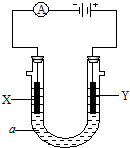 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,且通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,且通过导线与直流电源相连.请回答以下问题: