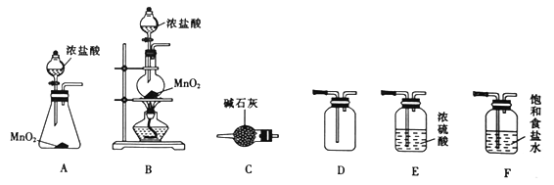
题目内容
【题目】同温同压下,11.2L CH4与H2的混合气体恰好与11.2L O2完全反应生成CO2和H2O,则原混合气体中的平均相对分子质量为( )
A. 5.56B. 6.67C. 11.12D. 9
【答案】B
【解析】
令CH4与H2的体积分别为x L、y L ,根据方程式CH4+2O2=CO2+2H2O、2H2+O2=2H2O 表示出各自消耗氧气的体积,根据二者体积之和与消耗氧气总体积列方程计算,同温同压下,体积之比等于物质的量之比,再根据平均摩尔质量M=m(混)/n(总)进行计算。
令CH4与H2的体积分别为x L、y L,则根据CH4+2O2=CO2+2H2O反应可知:V(O2)=2V(CH4)=2x L;根据2H2+O2=2H2O反应可知:V(O2)=![]() V(H2)=0.5y L;根据题意可得:x+y=2x+0.5y,故x:y=1:2;同温同压下,体积之比等于物质的量之比,故CH4与H2的物质的量之比=1:2,故CH4与H2的平均摩尔质量=(1×16+2×2)g÷(1+2)mol=6.67g/mol,相对分子质量为6.67;所以B选项是正确的;
V(H2)=0.5y L;根据题意可得:x+y=2x+0.5y,故x:y=1:2;同温同压下,体积之比等于物质的量之比,故CH4与H2的物质的量之比=1:2,故CH4与H2的平均摩尔质量=(1×16+2×2)g÷(1+2)mol=6.67g/mol,相对分子质量为6.67;所以B选项是正确的;
故答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如图所示:
 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式__________________________。
(2)NaClO3的作用是___________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。萃取剂的作用是_____;其使用的适宜pH范围是_____(填字母)。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取w g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取25.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。(5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O)
滴定次数实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 19.95 | 20.20 | 19.15 | 20.20 |
实验中所记录的数据如下表:
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、量筒、药匙和_________、____________。
(2)操作I为________操作Ⅱ为____________
(3)方案I中如何判断加入的氯化钡已经过量_____________,在方案Ⅱ中滴定终点的判断方法是________________。
(4)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为_________。
(5)上述实验中,由于操作错误所引起的误差分析正确的是_________
A.方案I中若没有洗涤操作,实验结果将偏小
B.方案I中若没有操作Ⅱ,实验结果将偏大
C.方案Ⅱ中,滴定管在滴定前无气泡,滴定后出现气泡,实验结果偏小
D.方案Ⅱ中,滴定终点时仰视读数,实验结果偏大