题目内容
【题目】NO2 与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0kJmol-1
2NO2(g) ΔH=-113.0kJmol-1
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJmol-1
2SO3(g) ΔH=-196.6kJmol-1
则NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=______________________。
SO3(g)+NO(g) ΔH=______________________。
(2)实验中,尾气可以用碱溶液吸收。NaOH 溶液吸收NO2时,发生的反应为:2NO2+2OH-=NO2-+NO3-+H2O,反应中的还原剂是__________;用NaOH 溶液吸收少量SO2的离子方程式为______________________________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2)∶n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示:
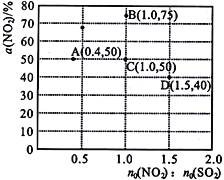
①当容器内_____(填标号)不再随时间的变化而改变时,可以判断反应达到了化学平衡状态。
a.气体的压强 b.气体的平均摩尔质量
c.气体的密度 d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是______________。
③若A 点对应实验中,SO2(g)的起始浓度为c0 molL-1,经过t min达到平衡状态,该时段化学反应速率v(NO2)=______________mol·L-1·min-1。
④图中C、D 两点对应的实验温度分别为Tc和Td,通过计算判断:Tc____Td(填 “>”、“=”或“<”)。
【答案】 -41.8kJ·mo1-1 NO2 SO2+2OH-==SO32-+H2O d 降低温度 c0/5t =
【解析】(1)已知:①2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0kJmol-1 ,②2SO2(g)+O2(g)
2NO2(g) ΔH=-113.0kJmol-1 ,②2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196.6 kJ mol-1,由盖斯定律可知:(②-①)/2可得: NO2(g)+SO2(g)
2SO3(g) △H=-196.6 kJ mol-1,由盖斯定律可知:(②-①)/2可得: NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH= -41.8kJ·mo1-1 。(2)在2NO2+2OH-=NO2-+NO3-+H2O中,NO2发生自身的氧化还原反应,NO2既是氧化剂又是还原剂,用NaOH 溶液吸收少量SO2的离子方程式为:SO2+2OH-==SO32-+H2O;(3)①由NO2(g)+SO2(g)
SO3(g)+NO(g) ΔH= -41.8kJ·mo1-1 。(2)在2NO2+2OH-=NO2-+NO3-+H2O中,NO2发生自身的氧化还原反应,NO2既是氧化剂又是还原剂,用NaOH 溶液吸收少量SO2的离子方程式为:SO2+2OH-==SO32-+H2O;(3)①由NO2(g)+SO2(g)![]() SO3(g)+NO(g)分析可知,反应前后气体的分子数不变、质量不变、容积不变,则气体的压强、平均摩尔质量、密度均为定值,不能作为达到了化学平衡状态的标志,而NO2的体积分数不变可以判断反应达到了化学平衡状态,答案选d;②如果要将图中C点的平衡状态改变为B点的平衡状态,可采取降低温度促进平衡正向移动达到目的;③若A点对应实验中,SO2(g)的起始浓度为c0 molL-1,因为n0(NO2)∶n0(SO2)=0.4时进行实验,则NO2起始浓度为0.4 c0 molL-1,则经过t min达到平衡状态,NO2转化率为50%,则这段时间内NO2的浓度变化为0.4 c0 molL-1/2,则经过t min达到平衡状态时,v(NO2)=
SO3(g)+NO(g)分析可知,反应前后气体的分子数不变、质量不变、容积不变,则气体的压强、平均摩尔质量、密度均为定值,不能作为达到了化学平衡状态的标志,而NO2的体积分数不变可以判断反应达到了化学平衡状态,答案选d;②如果要将图中C点的平衡状态改变为B点的平衡状态,可采取降低温度促进平衡正向移动达到目的;③若A点对应实验中,SO2(g)的起始浓度为c0 molL-1,因为n0(NO2)∶n0(SO2)=0.4时进行实验,则NO2起始浓度为0.4 c0 molL-1,则经过t min达到平衡状态,NO2转化率为50%,则这段时间内NO2的浓度变化为0.4 c0 molL-1/2,则经过t min达到平衡状态时,v(NO2)= 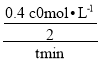 == c0/5t mol·L-1·min-1;④
== c0/5t mol·L-1·min-1;④
在C点时: NO2(g)+SO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
起始浓度 1 1 0 0
转化浓度 0.5 0.5 0.5 0.5
平衡浓度 0.5 0.5 0.5 0.5 Kc=1
在D点时: NO2(g)+SO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
起始浓度 1.5 1 0 0
转化浓度 0.6 0.6 0.6 0.6
平衡浓度 0.9 0.4 0.6 0.6 Kd=1
所以,Kc= Kd=1。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案