��Ŀ����
����Ŀ��H��N��O��Na��S��Cl������ѧ��ѧ�еij���Ԫ�أ���������ش�����ЩԪ���йص����⣺
(1)����Naԭ�ӽṹʾ��ͼ_______��Na2O2�������������������ʽΪ_______��
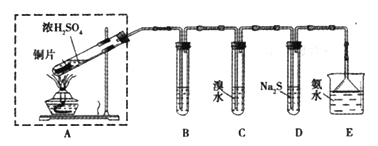
(2)Cl2��һ�ִ�����Ⱦ�װ��Һ�ȵĸ�ƿ��Ӧ���ı�ǩ��_______�����ţ���

����й©����NaHSO3��Һ��������д����ص����ӷ�Ӧ����ʽ_____________��
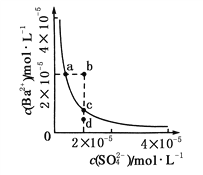
(3)25Cʱ������pH��ֽ���0.1mol/L��ˮ��pHԼΪ11������Թ������ˮ�ĵ��볣��ԼΪ_____����10mL����Һ��ͨ�����������������ܽ��������Һ�¶Ⱥ������С�仯����Һ��![]() ��_______(����� ����С������ȷ��������
��_______(����� ����С������ȷ��������
(4)�����ֻ�����ͬʱ����������Ԫ���е�����Ԫ�ء��������ֻ��������Һ��Ϻ�ǡ����ȫ��Ӧ��������֮һM�Ժ���������Ԫ�أ��÷�Ӧ�����ӷ���ʽΪ______________����M��Һ��pH =5������ˮ�������c(H+)=_______mol/L������Һ����Ũ���ɴ�С��˳��Ϊ___________��
���𰸡� ![]()
![]() C Cl2 +H2O+ HSO3-=2Cl-+SO42-+3H+ 1��10-5 ��С HSO3-+H+= SO2��+H2O 1��10-5 c(NH4+)> c(SO42-)>c(H+)>c(OH-)
C Cl2 +H2O+ HSO3-=2Cl-+SO42-+3H+ 1��10-5 ��С HSO3-+H+= SO2��+H2O 1��10-5 c(NH4+)> c(SO42-)>c(H+)>c(OH-)
����������1�����⿼�黯ѧ�������ȷʹ�ã�Naλ�ڵ������ڵ�IA�壬���ԭ�ӽṹʾ��ͼ��![]() ���������Ƶĵ���ʽΪ��
���������Ƶĵ���ʽΪ��![]() ����2��Һ�����ж���Һ�壬Ӧ����ǩΪC����ѡ��C��ȷ�����������������ԣ���NaHSO3������NaHSO4��������ӷ�Ӧ����ʽΪCl2��HSO3����H2O=2Cl����SO42����3H������3��NH3��H2O
����2��Һ�����ж���Һ�壬Ӧ����ǩΪC����ѡ��C��ȷ�����������������ԣ���NaHSO3������NaHSO4��������ӷ�Ӧ����ʽΪCl2��HSO3����H2O=2Cl����SO42����3H������3��NH3��H2O![]() NH4����OH����Kb=c(OH��)��c(NH4��)/c(NH3��H2O)��pH=11�����Ƴ�c(OH��)=Kw/c(H��)=10��3mol��L��1�����ݵ��뷽��ʽ��c(OH��)=c(NH4��)=10��3mol��L��1��NH3��H2O��������ʣ�����̶�������c(NH3��H2O)Լ����0.1mol��L��1��������ֵ��Kb=10��5��ͨ��NH3����Ȼ�ٽ����룬��NH3��H2O�ĵ���̶ȱ�С����˴˱�ֵ��С����4�����⿼��pH�ļ��������Ũ�ȴ�С�Ƚϣ����ֻ�������NH4HSO3��NH4HSO4�����߷�Ӧ�����ӷ���ʽΪHSO3����H��=SO2����H2O��MΪ(NH4)2SO4������������ǿ�������Σ�pH=5��˵����Һ��c(H��)=10��5mol��L��1����H����ȫ����ˮ�����������ˮ�����H����Ũ��Ϊ10��5mol��L��1��NH4����H2O
NH4����OH����Kb=c(OH��)��c(NH4��)/c(NH3��H2O)��pH=11�����Ƴ�c(OH��)=Kw/c(H��)=10��3mol��L��1�����ݵ��뷽��ʽ��c(OH��)=c(NH4��)=10��3mol��L��1��NH3��H2O��������ʣ�����̶�������c(NH3��H2O)Լ����0.1mol��L��1��������ֵ��Kb=10��5��ͨ��NH3����Ȼ�ٽ����룬��NH3��H2O�ĵ���̶ȱ�С����˴˱�ֵ��С����4�����⿼��pH�ļ��������Ũ�ȴ�С�Ƚϣ����ֻ�������NH4HSO3��NH4HSO4�����߷�Ӧ�����ӷ���ʽΪHSO3����H��=SO2����H2O��MΪ(NH4)2SO4������������ǿ�������Σ�pH=5��˵����Һ��c(H��)=10��5mol��L��1����H����ȫ����ˮ�����������ˮ�����H����Ũ��Ϊ10��5mol��L��1��NH4����H2O![]() NH3��H2O��H����NH4��ˮ��̶������������Ũ�ȴ�С˳����c(NH4��)>c(SO42��)>c(H��)>c(OH��)��
NH3��H2O��H����NH4��ˮ��̶������������Ũ�ȴ�С˳����c(NH4��)>c(SO42��)>c(H��)>c(OH��)��

 ���ݼ���ϵ�д�
���ݼ���ϵ�д�