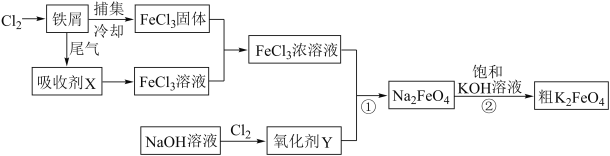
题目内容
【题目】常温下,向1LpH=10的NaOH溶液中持续通入CO2。通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述不正确的是( )

A. a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
B. b点溶液中:c(H+)=1×10-mmol·L-1
C. c点溶液中:c(Na+)>c(HCO3-)>c(CO32-)
D. d点溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
【答案】C
【解析】A、a点是没有通入CO2,此时的溶质为NaOH,水电离出的c(H+)=10-10mol·L-1,故A说法正确;B、水电离出c(OH-)等于水电离出的c(H+),因此水电离出的c(H+)=10-mmol·L-1,故B说法正确;C、c点,水电离出的c(OH-)的达到最大,此时的溶质为Na2CO3,CO32-水解:CO32-+H2O ![]() HCO3-+OH-,水解的程度微弱,即离子浓度大小顺序是c(Na+)>c(CO32-)>c(HCO3-),故C说法错误;D、根据电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D说法正确。
HCO3-+OH-,水解的程度微弱,即离子浓度大小顺序是c(Na+)>c(CO32-)>c(HCO3-),故C说法错误;D、根据电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D说法正确。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目