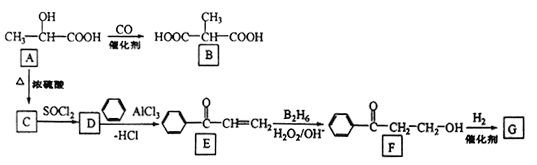
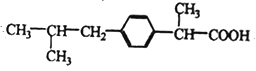
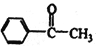
题目内容
【题目】(一)金属冶炼和处理常涉及氧化还原反应。
(1)如图为电解精炼银的示意图,__________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为___________。

(2)为处理银器表面的黑斑(Ag2S),可将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,该过程依据的是电化学中的_________原理(填“原电池”或“电解池”),食盐水的作用为________。
(二)FeCl3具有净水作用,但腐蚀设备,所以工业上常选用电浮选凝聚法处理污水.其原理是保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.某课外小组用电浮选凝聚法处理污水,设计如图所示装置示意图。

(3)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ_______________,Ⅱ_______________。
(4)该燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极,负极电极反应式为______________。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图),A物质的化学式是______。
【答案】 a 2H++NO3-+e-===NO2+H2O 原电池 作电解质溶液(或导电) Fe-2e-=Fe2+ 2H2O-4e-=4H++O2↑ CH4 -8e-+4CO32-=5CO2+2H2O CO2
【解析】(1)电解精炼时,粗银做阳极,所以粗银是a极;b电极是阴极,发生还原反应,生成了红棕色气体是NO2,电极反应:NO3-+e-+2H+=NO2↑+H2O,故答案为:a;NO3-+e-+2H+=NO2↑+H2O;
(2)该装置构成原电池,氯化钠溶液作电解质溶液,促进溶液的导电能力,故答案为:原电池;做电解质溶液;
(3)电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,同时也发生副反应,即溶液中的OH-失电子被氧化生成O2,故答案为:Fe-2e-=Fe2+;2H2O-4e-=4H++O2↑;
(4)该电池中通入甲烷的电极为负极,电极反应式为:CH4 -8e-+4CO32-=5CO2+2H2O;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳,故答案为:CH4 -8e-+4CO32-=5CO2+2H2O ;CO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案