题目内容
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____________。
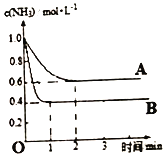
(2)在一密闭容器中投入一定量的氨气,发生反应2NH3![]() N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
请回答:
①曲线A中,反应在前2min内氢气的平均反应速率为________。此条件下的平衡常数K=____。
②在其它条件相同时,若改变某一条件,使该反应发生如图曲线B的反应情况,则此条件可能是改变_________(填“浓度”、“压强”、“温度”或“催化剂”)。简述判断理由_________。
(3)一定温度下,在恒压密闭容器中N2O5可发生下列反应:
①2N2O5(g)![]() 4NO2(g)+O2(g) ②2NO2(g)
4NO2(g)+O2(g) ②2NO2(g)![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6mol/L,c(O2)=1.2mol/L,则反应②中NO2的转化率为______,N2O5(g)的起始浓度应至少大于______mol/L.
【答案】 ΔH2 -3ΔH1 2NH3 -6e-+6OH-=N2 +6H2O 0.3 mol/(L·min) 0.12 温度 从图像变化趋势看,B比A反应速率加快,达平衡时NH3浓度小,所以只可能是升高温度 70% 1
【解析】(1)已知:①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则根据盖斯定律可知②-①×3即得到反应4NH3(g)+6NO(g)=5N2(g)+6H2O(1)的△H=△H2-3△H1。负极氨气发生失去电子的氧化反应,电解质溶液显碱性,则负极电极反应式为2NH3-6e-+6OH-=N2+6H2O。(2)①曲线A中,反应在前2min内消耗氨气是0.4mol/L,则根据方程式可知生成氢气是0.6mol/L,氢气的平均反应速率为0.6mol/L÷2min=0.3mol/(L·min)。2min时反应达到平衡状态,平衡时氮气是0.2mol/L,则此条件下的平衡常数K=![]() 。②从图像变化趋势可知,B比A反应速率加快,达平衡时NH3浓度小,由于正反应是体积增大的吸热的可逆反应,所以改变的条件只可能是升高温度。(3)设反应①中生成氧气是xmol/L,则生成NO2是4xmol/L,因此反应②中生成氧气是1.2mol/L-xmol/L,消耗NO2是2.4mol/L-2xmol/L,所以4xmol/L-(2.4mol/L-2xmol/L)=0.6mol/L,解得x=0.5,所以反应②中NO2的转化率为
。②从图像变化趋势可知,B比A反应速率加快,达平衡时NH3浓度小,由于正反应是体积增大的吸热的可逆反应,所以改变的条件只可能是升高温度。(3)设反应①中生成氧气是xmol/L,则生成NO2是4xmol/L,因此反应②中生成氧气是1.2mol/L-xmol/L,消耗NO2是2.4mol/L-2xmol/L,所以4xmol/L-(2.4mol/L-2xmol/L)=0.6mol/L,解得x=0.5,所以反应②中NO2的转化率为![]() 。由于是可逆反应,则N2O5(g)的起始浓度应至少大于2xmol/L=1mol/L。
。由于是可逆反应,则N2O5(g)的起始浓度应至少大于2xmol/L=1mol/L。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。
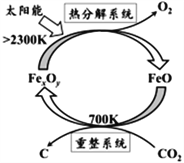
若“重整系统”发生的反应中![]() =6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
=6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题。
在一个2L密闭恒容容器中分别投入1.5molCO2、5.0molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。
C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。

①该反应的ΔH_________0 (填“>”“<”或“不能确定”);
②在TA温度下的平衡常数K=__________________。
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是:_______________________ (列举一项)。
④在TA温度下,其他条件不变,起始时若按1molCO2、2molH2、 lmolC2H4(g)、2molH2O(g)进行投料,此时v(正)________v(逆)。(填“>”“<”或“=”)。
(3) 用氨水吸收CO2制化肥碳铵(NH4HCO3)。
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
CO2(g)+H2O(1)![]() H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为____________________________;
②己知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5 |
Ka1(H2CO3) | 4×10-7 |
Ka2(H2CO3) | 4×10-11 |
则反应NH4++ HCO3-+H2O![]() NH3·H2O +H2CO3的平衡常数K=________________。
NH3·H2O +H2CO3的平衡常数K=________________。