ΧβΡΩΡΎ»ί
Ρ≥Μ·―ßΜνΕ·–ΓΉι…ηΦΤ»γœ¬ΆΦΥυ Ψ(≤ΩΖ÷Φ–≥÷ΉΑ÷Ο“―¬‘»Ξ) Β―ιΉΑ÷ΟΘ§“‘ΧΫΨΩ≥± ΣΒΡCl2”κNa2CO3Ζ¥”ΠΒΟΒΫΒΡΙΧΧεΈο÷ ΓΘ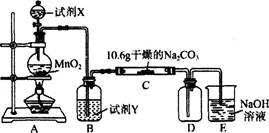
Θ®1Θ©–¥≥ωΉΑ÷ΟA÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ
Θ®2Θ©–¥≥ω ‘ΦΝYΒΡΟϊ≥ΤΘΚ_____________________ΓΘ
Θ®3Θ©“―÷ΣΘΚΆ®»κ“ΜΕ®ΝΩΒΡ¬»ΤχΚσΘ§≤βΒΟD÷–÷Μ”–“Μ÷÷≥ΘΈ¬œ¬ΈΣΜΤΚλ…ΪΒΡΤχΧεΘ§ΤδΈΣΚ§¬»―θΜ·ΈοΓΘΩ…“‘»ΖΕ®ΒΡ «C÷–Κ§”–ΒΡ¬»―Έ÷Μ”–“Μ÷÷Θ§«“Κ§”–NaHCO3Θ§œ÷Ε‘C≥…Ζ÷Ϋχ––≤¬œκΚΆΧΫΨΩΓΘ
ΔΌΧα≥ωΚœάμΦΌ…ηΘΚ
ΦΌ…η“ΜΘΚ¥φ‘ΎΝΫ÷÷≥…Ζ÷ΘΚ NaHCO3ΚΆ__________
ΦΌ…ηΕΰΘΚ¥φ‘Ύ»ΐ÷÷≥…Ζ÷ΘΚ NaHCO3ΚΆ__________ΓΔ___________ΓΘ
ΔΎ…ηΦΤΖΫΑΗΘ§Ϋχ–– Β―ιΓΘ«κ–¥≥ω Β―ι≤Ϋ÷η“‘ΦΑ‘ΛΤΎœ÷œσΚΆΫα¬έ(Ω…≤ΜΧν¬ζ)ΓΘ
œό―Γ Β―ι ‘ΦΝΚΆ“«ΤςΘΚ’τΝσΥ°ΓΔœΓœθΥαΓΔBaCl2»ή“ΚΓΔ≥Έ«ε ·Μ“Υ°ΓΔAgNO3»ή“ΚΓΔ ‘ΙήΓΔ–Γ…’±≠ΓΘ
| Β―ι≤Ϋ÷η | ‘ΛΤΎœ÷œσΚΆΫα¬έ |
| ≤Ϋ÷η1ΘΚ»ΓC÷–ΒΡ…ΌΝΩΙΧΧε―υΤΖ”Ύ ‘Ιή÷–Θ§ΒΈΦ” ΉψΝΩ’τΝσΥ°÷ΝΙΧΧε»ήΫβΘ§»ΜΚσΫΪΥυΒΟ»ή“ΚΖ÷±π÷Ο”ΎAΓΔB ‘Ιή÷–ΓΘ | |
| ≤Ϋ÷η2ΘΚœρA ‘Ιή÷–ΒΈΦ”______________ΘΚ | ΔΌ»τΈόΟςœ‘œ÷œσΘ§÷ΛΟςΙΧΧε÷–≤ΜΚ§ΧΦΥαΡΤΘΜ ΔΎ»τ»ή“Κ±δΜκΉ«Θ§÷ΛΟςΙΧΧε÷–Κ§”–ΧΦΥαΡΤΓΘ |
| ≤Ϋ÷η3ΘΚœρB ‘Ιή÷–ΒΈΦ”______________ΘΚ | »τ»ή“Κ±δΜκΉ«Θ§ΫαΚœ≤Ϋ÷η2÷–ΒΡΔΌΘ§‘ρΦΌ…η “Μ≥…ΝΔΘΚΫαΚœ≤Ϋ÷η2÷–ΒΡΔΎΘ§‘ρΦΌ…ηΕΰ≥…ΝΔΓΘ |
Θ®4Θ©ΦΚ÷ΣC÷–”–0.1 mol Cl2≤ΈΦ”Ζ¥”ΠΓΘ»τΦΌ…η“Μ≥…ΝΔΘ§Ω…ΆΤ÷ΣC÷–Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ ΓΘ
Θ®5Θ©≥ΘΈ¬œ¬Na2CO3ΚΆNaHCO3ΨυΈΣ0.1mol/LΒΡΜλΚœ»ή“Κ÷–Θ§c(OH©¹)-c(H+)=___________(”ΟΚ§ΧΦ‘ΣΥΊΒΡΝΘΉ”≈®Ε»±μ Ψ)Θ§‘ΎΗΟ»ή“Κ÷–ΒΈΦ”œΓ―ΈΥα÷Ν÷––‘ ±Θ§»ή“Κ÷–»ή÷ ΒΡ≥…Ζ÷”–______________________ΓΘ
Θ®1Θ©4H+ +2Cl- +MnO2=Mn2+ +Cl2Γϋ+2H2O(2Ζ÷)
Θ®2Θ©±ΞΚΆ ≥―ΈΥ°Θ®2Ζ÷Θ©
Θ®3Θ©NaClΘΜ NaClΓΔNa2CO3 Θ®Ης1Ζ÷Θ©ΘΜBaCl2»ή“ΚΘ®2Ζ÷Θ©ΘΜAgNO3»ή“ΚΘ®2Ζ÷Θ©
Θ®4Θ©2Cl2+ 2Na2CO3 + H2O ="2" NaHCO3 + 2NaCl+ Cl2O(2Ζ÷)
Θ®5Θ©1/2 c (HCO3-)+3/2 c (H2CO3)-1/2 c(CO32-)(2Ζ÷)ΘΜNaClΓΔNaHCO3 ΓΔCO2(ΜρH2CO3)Θ®2Ζ÷Θ©
ΫβΈω ‘ΧβΖ÷ΈωΘΚ Θ®1Θ©±ΨΧβΧΫΨΩΒΡ «¬»ΤχΚΆΧΦΥαΡΤΖ¥”ΠΘ§Υυ“‘AΉΑ÷ΟΈΣ¬»ΤχΒΡ÷Τ±ΗΉΑ÷ΟΘ§Υυ“‘ΖΔ…ζΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ4H+ +2Cl- +MnO2=Mn2+ +Cl2Γϋ+2H2OΓΘ
Θ®2Θ©≈®―ΈΥα“ΉΜ”ΖΔΘ§Υυ“‘¬»Τχ÷–Μλ”–HClΤχΧεΘ§BΉΑ÷ΟΈΣ≥ΐ‘”ΉΑ÷ΟΘ§ ‘ΦͯÔϱΞΚΆ ≥―ΈΥ°»ή“ΚΓΘ
Θ®3Θ©ΔΌΗυΨίΧβ“βΘ§Ζ¥”ΠΥυΒΟΒΡC÷–÷Μ”–“Μ÷÷¬»―ΈΘ§ΜΙΚ§”–NaHCO3Θ§Υυ“‘ΗΟ¬»―Έ «NaClΘ§Υυ“‘ΦΌ…η“ΜΈΣNaHCO3ΚΆNaClΘ§ΦΌ…ηΕΰΒΡ»ΐ÷÷≥…Ζ÷Ζ÷±πΈΣNaHCO3 ΓΔNaClΓΔNa2CO3 ΓΘ
ΔΎ…ηΦΤΖΫΑΗ―ι÷ΛΦΌ…ηΘ§‘ρ”ΠΗΟ÷ΛΟςNaClΓΔNa2CO3 ΒΡ¥φ‘ΎΘ§Φ¥÷ΛΟςCl-ΓΔCO32- ΒΡ¥φ‘ΎΓΘΗυΨί Β―ι≤Ϋ÷ηΘ§≤Ϋ÷η2ΈΣΧΦΥαΗυΒΡΦλ―ιΘ§“ρ¥ΥΩ…―Γ”Ο ‘ΦΝBaCl2»ή“ΚΘ§»τ”–ΑΉ…Ϊ≥ΝΒμ≤ζ…ζΘ§ΥΒΟς”–ΧΦΥαΡΤΘ§ΈόΟςœ‘œ÷œσ‘ρΟΜ”–ΧΦΥαΡΤΘΜ≤Ϋ÷η3ΈΣΦλ―鬻άκΉ”Θ§“ρ¥Υ―Γ”Ο ‘ΦΝAgNO3»ή“ΚΘ§»τΑΉ…Ϊ≥ΝΒμ≤ζ…ζ±δΜκΉ«‘ρ¥φ‘Ύ¬»Μ·ΡΤΘ§»τΈόΟςœ‘œ÷œσΘ§‘ρΈό¬»Μ·ΡΤΘ§‘ΌΫαΚœ≤Ϋ÷η2Χ÷¬έΦΌ…η≥…ΝΔΓΘ
Θ®4Θ© »τΦΌ…η“Μ≥…ΝΔΘ§‘ρ…ζ≥…ΈοΈΣ¬»Μ·ΡΤΚΆΧΦΥα«βΡΤΘ§Υυ“‘±Ί»Μ”–H2O≤ΈΦ”Ζ¥”ΠΘ§Ά§ ±…ζ≥…ΝΥΜΤΚλ…ΪΒΡΤχΧεΘ§Υυ“‘ΗΟΤχΧεΈΣ¬»ΒΡ―θΜ·ΈοCl2OΘ§ΖΔ…ζΝΥ―θΜ·ΜΙ‘≠Ζ¥”ΠΘ§ΖΫ≥Χ ΫΈΣΘΚ2Cl2+ 2Na2CO3 + H2O ="2" NaHCO3 + 2NaCl+ Cl2OΓΘ
Θ®5Θ©ΗυΨίΒγΚ… ΊΚψΘ§œύΆ§ΧθΦΰœ¬≈®Ε»ΨυΈΣ0.1mol/LNa2CO3ΚΆNaHCO3ΒΡΜλΚœ»ή“Κ”–ΒγΚ… ΊΚψ ΫΘΚc(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)Θ§»τ≤ΜΩΦ¬«»θάκΉ”Υ°ΫβΘ§‘ρc(Na+)=0.3mol/LΘ§c(CO32-)=c(HCO3-)=0.1mol/LΘ§Υυ“‘c(Na+)=3/2[c(CO32-)«Α+c(HCO3-)«Α]ΘΜ”…”ΎCO32-ΓΔHCO3-ΨυΖΔ…ζΥ°Ϋβ≤ζ…ζΝΥH2CO3 Θ§Υυ“‘Υ°Ϋβ“‘Κσc(Na+)=3/2[c(CO32-)«Α+c(HCO3-)«Α]=3/2[c(CO32-)+c(HCO3-) +C(H2CO3)]ΘΜΑ―¥Υ Ϋ¥χ»κΒΫΒγΚ… ΊΚψ ΫΒΟ3/2[c(CO32-)+c(HCO3-) +C(H2CO3)] +c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)Θ§“ΤœνΒΟc(OH©¹)-c(H+)=3/2[c(CO32-)+c(HCO3-) +C(H2CO3)]- 2c(CO32-)-c(HCO3-)="1/2" c (HCO3-)+3/2 c (H2CO3)-1/2 c(CO32-)ΓΘ‘ΎΗΟ»ή“Κ÷–ΒΈΦ”œΓ―ΈΥα÷Ν÷––‘ ±Θ§»ή“Κ÷–»ή÷ ΒΡ≥…Ζ÷”–NaClΓΔNaHCO3 ΓΔCO2 ΓΘ
ΩΦΒψΘΚ±ΨΧβΩΦ≤ιΒΡ « Β―ιΧΫΨΩΓΔ―θΜ·ΜΙ‘≠Ζ¥”ΠΖΫ≥Χ ΫΒΡ≈δΤΫΓΔάκΉ”Φλ―ιΓΔάκΉ”≈®Ε»¥σ–Γ±»ΫœΒ»ΓΘ

(14Ζ÷)Ρ≥–Υ»Λ–ΓΉιΆ§―ß‘Ύ Β―ι “”ΟΦ”»»1-ΕΓ¥ΦΓΔ≈®H2SO4ΚΆδεΜ·ΡΤΜλΚœΈοΒΡΖΫΖ®ά¥÷Τ±Η1-δεΕΓΆιΘ§≤ΔΦλ―ιΖ¥”ΠΒΡ≤ΩΖ÷Η±≤ζΈοΘ§…ηΦΤΝΥ»γΆΦΥυ ΨΉΑ÷ΟΘ§Τδ÷–Φ–≥÷“«ΤςΓΔΦ”»»“«ΤςΦΑά以հΙήΟΜ”–Μ≠≥ωΓΘ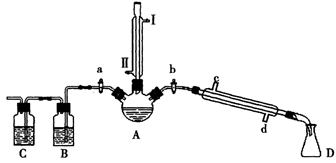
«κΗυΨί Β―ι≤Ϋ÷ηΘ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΙΊ±’aΚΆbΓΔΫ”Ά® ζ÷±άδΡΐΙήΒΡάδΡΐΥ°Θ§ΗχAΦ”»»30Ζ÷÷”Θ§÷Τ±Η1-δεΕΓΆιΓΘ
ζ÷±άδΡΐΙήΫ”Ά®άδΡΐΥ°Θ§ΫχΥ°ΩΎ «_____(ΧνΓΑIΓ±ΜρΓΑΔρΓ±)ΘΜάδΡΐΜΊΝςΒΡ÷ς“ΣΡΩΒΡ «________ΓΘ
Θ®2Θ©άμ¬έ…œΘ§…œ ωΖ¥”ΠΒΡΗ±≤ζΈοΩ…Ρή”–ΘΚΕΓΟ―(CH3CH2CH2CH2-O-CH2CH2CH2CH3)ΓΔ1-ΕΓœ©ΓΔδεΜ·«βΓΔΝρΥα«βΡΤΓΔΥ°Β»ΓΘœ®ΟπΨΤΨΪΒΤΘ§‘Ύ ζ÷±άδΡΐΙή…œΖΫ»ϊ…œ»ϊΉ”≤Δ¥ρΩΣaΘ§άϊ”Ο”ύ»»ΦΧ–χΖ¥”Π÷±÷Νά以ȧΆ®ΙΐBΓΔCΉΑ÷ΟΦλ―ι≤ΩΖ÷Η±≤ζΈοΓΘ
BΓΔC÷–”Π ΔΖ≈ΒΡ ‘ΦΝΖ÷±π «_________ΚΆ Θ§–¥≥ωCΉΑ÷Ο÷–÷ς“ΣΒΡΜ·―ßΖΫ≥Χ ΫΘΚ___________ΓΘ
Θ®3Θ©ΈΣΝΥΫχ“Μ≤ΫΖ÷άκΧα¥Ω1-δεΕΓΆιΘ§ΗΟ–Υ»Λ–ΓΉιΆ§―ß≤ιΒΟœύΙΊ”–ΜζΈοΒΡ ΐΨί»γ±μΥυ ΨΘΚ
| Έο÷ | »έΒψ/Γφ | Ζ–Βψ/Γφ |
| 1-ΕΓ¥Φ | -89Θ°5 | 117Θ°3 |
| 1-δεΕΓΆι | -112Θ°4 | 101Θ°6 |
| ΕΓΟ― | -95Θ°3 | 142Θ°4 |
| 1-ΕΓœ© | -185Θ°3 | -6Θ°5 |
«κΡψ≤Ι≥δœ¬Ν– Β―ι≤Ϋ÷ηΘ§÷±ΒΫΖ÷άκ≥ω1-δεΕΓΆιΓΘ
ΔΌ¥ΐ…’ΤΩά以ΚσΘ§ΑΈ»Ξ ζ÷±ΒΡάδΡΐΙήΘΜ
ΔΎ____ΘΜΔέ_____ΘΜΔή_______ΘΜΔί_______Θ§ ’Φ·ΥυΒΟΝσΖ÷ΓΘ
Θ®4Θ©»τ Β―ι÷–Υυ»Γ1-ΕΓ¥ΦΓΔNaBrΖ÷±πΈΣ7Θ°4 gΓΔ13Θ°0 gΘ§’τ≥ωΒΡ¥÷≤ζΈοΨ≠œ¥Β”ΓΔΗ…‘οΚσ‘Ό¥Έ’τΝσΒΟΒΫ9Θ°6 g1-δεΕΓΆιΘ§‘ρ1-δεΕΓΆιΒΡ≤ζ¬ «_____ΓΘΘ®±ΘΝτ2ΈΜ”––ß ΐΉ÷Θ©
ΝρΥαΆ≠ ή»»Ζ÷Ϋβ…ζ≥…―θΜ·Ά≠ΚΆΤχΧεΘ§Φ”»»Έ¬Ε»≤ΜΆ§Θ§ΤχΧε≥…Ζ÷“≤≤ΜΆ§ΓΘΤχΧε≥…Ζ÷Ω…ΡήΚ§SO2ΓΔSO3ΚΆO2÷–ΒΡ“Μ÷÷ΓΔΝΫ÷÷Μρ»ΐ÷÷ΓΘΡ≥Μ·―ßΩΈΆβΜνΕ·–ΓΉιΆ®Ιΐ…ηΦΤΧΫΨΩ–‘ Β―ιΘ§≤βΕ®Ζ¥”Π≤ζ…ζΒΡSO2ΓΔSO3ΚΆO2ΒΡΈο÷ ΒΡΝΩΘ§≤ΔΦΤΥψ»ΖΕ®ΗςΈο÷ ΒΡΜ·―ßΦΤΝΩ ΐΘ§¥”Εχ»ΖΕ®CuSO4Ζ÷ΫβΒΡΜ·―ßΖΫ≥Χ ΫΓΘ Β―ι”ΟΒΫΒΡ“«Τς»γœ¬ΆΦΥυ ΨΘΚ
[Χα≥ω≤¬œκ]
Δώ.ΥυΒΟΤχΧεΒΡ≥…Ζ÷Ω…Ρή÷ΜΚ§SO3“Μ÷÷ΘΜ
Δρ.ΥυΒΟΤχΧεΒΡ≥…Ζ÷Ω…ΡήΚ§”–________ΝΫ÷÷ΘΜ
Δσ.ΥυΒΟΤχΧεΒΡ≥…Ζ÷Ω…ΡήΚ§”–________»ΐ÷÷ΓΘ
[ Β―ιΧΫΨΩ]
Β―ι≤ΌΉςΙΐ≥Χ¬‘ΓΘ“―÷Σ Β―ιΫα χ ±Θ§ΝρΥαΆ≠Άξ»ΪΖ÷ΫβΓΘ
(1)«κΡψΉιΉΑΧΫΨΩ Β―ιΒΡΉΑ÷ΟΘ§Α¥¥”Ήσ÷Ν”“ΒΡΖΫœρΘ§Ης“«ΤςΫ”ΩΎΒΡΝ§Ϋ”Υ≥–ρΈΣΔΌΓζΔαΓζΔβΓζΔόΓζΔίΓζ________Γζ________Γζ________Γζ________ΓζΔΎ(ΧνΫ”ΩΎ–ρΚ≈)ΓΘ
(2)»τ Β―ιΫα χ ±B÷–ΝΩΆ≤ΟΜ”– ’Φ·ΒΫΥ°Θ§‘ρ÷ΛΟς≤¬œκ________’ΐ»ΖΓΘ
(3)”–ΝΫΗω Β―ι–ΓΉιΫχ––ΗΟ Β―ιΘ§”…”ΎΦ”»» ±ΒΡΈ¬Ε»≤ΜΆ§Θ§ Β―ιΫα χΚσ≤βΒΟœύΙΊ ΐΨί“≤≤ΜΆ§Θ§ ΐΨί»γœ¬ΘΚ
| Β―ι–ΓΉι | ≥Τ»ΓCuSO4ΒΡ÷ ΝΩ/g | ΉΑ÷ΟC‘ωΦ”ΒΡ÷ ΝΩ/g | ΝΩΆ≤÷–Υ°ΒΡΧεΜΐ’έΥψ≥…±ξΉΦΉ¥Ωωœ¬ΤχΧεΒΡΧεΜΐ/mL |
| “Μ | 6.4 | 2.56 | 448 |
| Εΰ | 6.4 | 2.56 | 224 |
«κΆ®ΙΐΦΤΥψΘ§ΆΤΕœ≥ωΒΎ“Μ–ΓΉιΚΆΒΎΕΰ–ΓΉιΒΡ Β―ιΧθΦΰœ¬CuSO4Ζ÷ΫβΒΡΜ·―ßΖΫ≥Χ ΫΓΘ
ΒΎ“Μ–ΓΉιΘΚ______________________________________________ΘΜ
ΒΎΕΰ–ΓΉιΘΚ_______________________________________________ΓΘ
¥ΦΆ―Υ° «Κœ≥…œ©ΧΰΒΡ≥Θ”ΟΖΫΖ®Θ§ Β―ι “Κœ≥…ΦΚœ©ΒΡΖ¥”ΠΚΆ Β―ιΉΑ÷Ο»γœ¬ΘΚ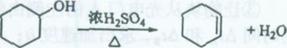
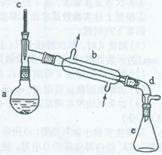
Ω…Ρή”ΟΒΫΒΡ”–ΙΊ ΐΨί»γœ¬ΘΚ
| | œύΕ‘Ζ÷Ή”÷ ΝΩ | ΟήΕ»Θ·(gΓΛcmΘ≠3) | Ζ–ΒψΘ·Γφ | »ήΫβ–‘ |
| ΜΖΦΚ¥Φ | 100 | 0.9618 | 161 | ΈΔ»ή”ΎΥ° |
| ΜΖΦΚœ© | 82 | 0.8102 | 83 | Ρ―»ή”ΎΥ° |
‘Ύa÷–Φ”»κ20 gΜΖΦΚ¥ΦΚΆ2–ΓΤ§Υι¥…Τ§Θ§ά以ΫΝΕ·œ¬¬ΐ¬ΐΦ”»κ1 mL≈®ΝρΥαΓΘb÷–Ά®»κά以հΚσΘ§ΩΣ ΦΜΚ¬ΐΦ”»»aΘ§ΩΊ÷ΤΝσ≥ωΈοΒΡΈ¬Ε»≤Μ≥§Ιΐ90ΓφΓΘ
Ζ÷άκΧα¥ΩΘΚ
Ζ¥”Π¥÷≤ζΈοΒΙ»κΖ÷“Κ¬©ΕΖ÷–Ζ÷±π”Ο…ΌΝΩ5ΘΞΧΦΥαΡΤ»ή“ΚΚΆΥ°œ¥Β”Θ§Ζ÷άκΚσΦ”»κΈόΥ°¬»Μ·ΗΤΩ≈ΝΘΘ§Ψ≤÷Ο“ΜΕΈ ±ΦδΚσΤζ»Ξ¬»Μ·ΗΤΓΘΉν÷’Ά®Ιΐ’τΝσΒΟΒΫ¥ΩΨΜΜΖΦΚœ©l0 gΓΘ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΉΑ÷ΟbΒΡΟϊ≥Τ «______ΓΘ
Θ®2Θ©Φ”»κΥι¥…Τ§ΒΡΉς”Ο «_______________________ΘΜ»γΙϊΦ”»»“ΜΕΈ ±ΦδΚσΖΔœ÷ΆϋΦ«Φ”¥…Τ§Θ§”ΠΗΟ≤…»ΓΒΡ’ΐ»Ζ≤ΌΉς «(Χν’ΐ»Ζ¥πΑΗ±ξΚ≈) ΓΘ
AΘ°ΝΔΦ¥≤ΙΦ” BΘ°ά以Κσ≤ΙΦ” CΘ°≤Μ–η≤ΙΦ” DΘ°÷Ί–¬≈δΝœ
Θ®3Θ©±Ψ Β―ι÷–Ήν»ί“Ή≤ζ…ζΒΡΗ±≤ζΈοΒΡΫαΙΙΦρ ΫΈΣ__________ΓΘ
Θ®4Θ©Ζ÷“Κ¬©ΕΖ‘Ύ Ι”Ο«Α–κ«εœ¥Η…ΨΜ≤Δ__________ΘΜ‘Ύ±Ψ Β―ιΖ÷άκΙΐ≥Χ÷–Θ§≤ζΈο”ΠΗΟ¥”Ζ÷“Κ¬©ΕΖΒΡ______(ΧνΓΑ…œΩΎΒΙ≥ωΓ±ΜρΓΑœ¬ΩΎΖ≈≥ωΓ±)ΓΘ
Θ®5Θ©Ζ÷άκΧα¥ΩΙΐ≥Χ÷–Φ”»κΈόΥ°¬»Μ·ΗΤΒΡΡΩΒΡ «_________________________ΓΘ
Θ®6Θ©‘ΎΜΖΦΚœ©¥÷≤ζΈο’τΝσΙΐ≥Χ÷–Θ§≤ΜΩ…Ρή”ΟΒΫΒΡ“«Τς”–__________(Χν’ΐ»Ζ¥πΑΗ±ξΚ≈)ΓΘ
AΘ°’τΝσ…’ΤΩ BΘ°Έ¬Ε»ΦΤ CΘ°≤ΘΝßΑτ DΘ°άδΡΐΙή
Θ®7Θ©±Ψ Β―ιΥυΒΟΒΫΒΡΜΖ“―œ©≤ζ¬ «__________(Χν’ΐ»Ζ¥πΑΗ±ξΚ≈)ΓΘ
AΘ°41ΘΞ BΘ°50ΘΞ CΘ°61ΘΞ DΘ°70ΘΞ
Ά®Ιΐ≥ΝΒμΘ≠―θΜ·Ζ®¥ΠάμΚ§ΗθΖœΥ°Θ§Φθ…ΌΖœ“Κ≈≈Ζ≈Ε‘ΜΖΨ≥ΒΡΈέ»ΨΘ§Ά§ ±ΜΊ ’
K2Cr2O7ΓΘ Β―ι “Ε‘Κ§ΗθΖœ“ΚΘ®Κ§”–Cr3+ΓΔFe3+ΓΔK+ΓΔSO42Θ≠ΓΔNO3Θ≠ΚΆ…ΌΝΩCr2O72Θ≠Θ©ΜΊ ’”κ‘Όάϊ”ΟΙΛ“’»γœ¬ΘΚ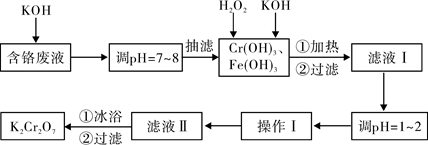
“―÷ΣΘΚΔΌCr(OH)3+OHΘ≠=CrO2Θ≠+2H2OΘΜ
ΔΎ2CrO2Θ≠+3H2O2+2OHΘ≠=2CrO42Θ≠+4H2OΘΜ
ΔέH2O2‘ΎΥα–‘ΧθΦΰœ¬ΨΏ”–ΜΙ‘≠–‘Θ§ΡήΫΪ+6ΦέCrΜΙ‘≠ΈΣ+3ΦέCrΓΘ
Θ®1Θ© Β―ι÷–Υυ”ΟKOH≈®Ε»ΈΣ6 molΓΛLΘ≠1Θ§œ÷”ΟKOHΙΧΧε≈δ÷Τ250mL 6 molΓΛLΘ≠1 ΒΡKOH»ή“ΚΘ§≥ΐ…’±≠ΓΔ≤ΘΝßΑτΆβΘ§ΜΙ±Ί–η”ΟΒΫΒΡ≤ΘΝß“«Τς”– ΓΘ
Θ®2Θ©”…”ΎΚ§ΗθΖœ“Κ÷–Κ§”–…ΌΝΩΒΡK2Cr2O7Θ§≥ι¬Υ ±Ω…”Ο ¥ζΧφ≤Φ œ¬©ΕΖΘΜ≥ι¬ΥΙΐ≥Χ
÷–“ΣΦΑ ±Ιέ≤λΈϋ¬ΥΤΩΡΎ“ΚΟφΗΏΕ»Θ§Β±Ωλ¥οΒΫ÷ßΙήΩΎΈΜ÷Ο ±”ΠΫχ––ΒΡ≤ΌΉςΈΣ ΓΘ
Θ®3Θ©¬Υ“ΚΔώΥαΜ·«ΑΘ§Ϋχ––Φ”»»ΒΡΡΩΒΡ « ΓΘ±υ‘ΓΓΔΙΐ¬ΥΚσΘ§”Π”Ο…ΌΝΩάδΥ°œ¥Β”K2Cr2O7Θ§ΤδΡΩΒΡ « ΓΘ
Θ®4Θ©œ¬±μ «œύΙΊΈο÷ ΒΡ»ήΫβΕ» ΐΨίΘΚ
| Έο÷ | 0Γφ | 20Γφ | 40Γφ | 60Γφ | 80Γφ | 100Γφ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
ΗυΨί»ήΫβΕ» ΐΨίΘ§≤ΌΉςΔώΨΏΧε≤ΌΉς≤Ϋ÷ηΈΣΔΌ ΓΔΔΎ ΓΘ
Θ®5Θ©≥Τ»Γ≤ζΤΖ÷ΊΗθΥαΦΊ ‘―υ2.000g≈δ≥…250mL»ή“ΚΘ§»Γ≥ω25.00mL”ΎΉΕ–ΈΤΩ÷–Θ§Φ”»κ10mL 2 molΓΛLΘ≠1H2SO4ΚΆΉψΝΩΒβΜ·ΡΤΘ®ΗθΒΡΜΙ‘≠≤ζΈοΈΣCr3+Θ©Θ§Ζ≈”ΎΑΒ¥Π5minΘ§»ΜΚσΦ”»κ100mLΥ°Θ§Φ”»κ3mLΒμΖέ÷Η ΨΦΝΘ§”Ο0.1200 molΓΛLΘ≠1Na2S2O3±ξΉΦ»ή“ΚΒΈΕ®Θ®I2+2S2O32Θ≠=2IΘ≠+S4O62Θ≠Θ©ΓΘ
ΔΌ»τ Β―ι÷–Ι≤”Ο»ΞNa2S2O3±ξΉΦ»ή“Κ30.00mLΘ§ΥυΒΟ≤ζΤΖΒΡ÷–÷ΊΗθΥαΦΊΒΡ¥ΩΕ»ΈΣ Θ®…η’ϊΗωΙΐ≥Χ÷–ΤδΥϋ‘”÷ ≤Μ≤Έ”κΖ¥”ΠΘ©ΓΘ
ΔΎ»τΒΈΕ®Ιή‘Ύ Ι”Ο«ΑΈ¥”ΟNa2S2O3±ξΉΦ»ή“Κ»σœ¥Θ§≤βΒΟΒΡ÷ΊΗθΥαΦΊΒΡ¥ΩΕ»ΫΪΘΚ Θ®ΧνΓΑΤΪΗΏΓ±ΓΔΓΑΤΪΒΆΓ±ΜρΓΑ≤Μ±δΓ±Θ©ΓΘ
TMB «“Μ÷÷–¬–Ά÷ΗΈΤΦλ≤βΒΡ…Ϊ‘≠ ‘ΦΝΘ§”…ΧΦΓΔ«βΓΔΒΣ»ΐ÷÷‘ΣΥΊΉι≥…Θ§”κ«βΤχΒΡœύΕ‘Ζ÷Ή”÷ ΝΩ÷°±»ΈΣ120ΓΘΡ≥―–ΨΩ–‘―ßœΑ–ΓΉιΒΡΆ§―ß”ϊάϊ”Οœ¬Ν–“«Τς≤βΕ®TMBΒΡΖ÷Ή” ΫΓΘΤδ÷ς“ΣΙΐ≥ΧΈΣ‘ΎΉψΝΩ―θΤχΝς÷–ΫΪ4.80 g TMB―υΤΖ―θΜ·(ΒΣ‘ΣΥΊΉΣΜ·ΈΣN2)Θ§‘Όάϊ”ΟΈϋ ’ΦΝΖ÷±πΈϋ ’Υ°’τΤχΚΆCO2ΓΘ«κ¥”ΆΦ÷–―Γ‘ώ Β±ΒΡΉΑ÷Ο(ΉΑ÷ΟΖϊΚœΤχΟή–‘“Σ«σΘ§Φ”»»ΉΑ÷ΟΒ»“―¬‘»ΞΘ§ΤδΥϊ”ΟΤΖΩ…Ή‘―Γ)ΓΘ
Θ®1Θ©ΫΪΥυ―Γ”ΟΒΡ“«Τς(Ω…÷ΊΗ¥―Γ”Ο)Ν§Ϋ”Υ≥–ρ”……œΒΫœ¬“ά¥ΈΧν»κœ¬±μΘ§≤Δ–¥≥ωΗΟ“«Τς÷–”ΠΦ”»κΒΡ ‘ΦΝΒΡΟϊ≥ΤΦΑΉς”ΟΓΘ
| ―Γ”ΟΒΡ“«Τς | Φ”»κ ‘ΦΝ | Φ”»κ ‘ΦΝΒΡΉς”Ο |
| C | H2O2»ή“Κ”κMnO2 | ≤ζ…ζ―θΤχ |
| | | |
| | | |
| D | CuOΖέΡ© | ΫΪΩ…Ρή…ζ≥…ΒΡCOΉΣΜ·ΈΣCO2 |
| | | |
| | | |
| | | |
Θ®2Θ© Β―ιΚσ≥ΤΒΟAΦΑ“‘ΚσΒΡΉΑ÷Ο(Ψυ”ΟAΉΑ÷Ο≤ΔΦΌ…ηΟΩ¥ΈΈϋ ’Ψυ «Άξ»ΪΒΡ)÷ ΝΩ“ά¥Έ‘ωΦ”3.60 gΓΔ14.08 gΓΔ0.14 gΘ§‘ρTMBΒΡΖ÷Ή” ΫΈΣ__________________________ΓΘ





