题目内容
【题目】常温下,向 1L 0.10 mol·L-1CH3COONa 溶液中,不断通入HC1气体(忽略溶液体积变化),得到 c (CH3COO-)和c(CH3COOH)与 pH 的变化关系如下,则下列说法正确的是
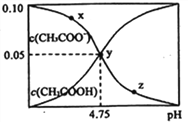
A. 溶液的pH比较:x<y <z
B. 在y点再通入0.05 mol HCl气体,溶液中离子浓度大小比较:c(Na+) =c(Cl-) > c(H+) >c(CH3COO-) >c(OH-)
C. 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点
D. 该温度下,CH3COOH的Ka=104.75
【答案】C
【解析】A.因CH3COO-的水解,CH3COONa 溶液显碱性,通入HCl气体后溶液的碱性逐渐减弱,酸性增强,则pH比较是x>y>z,故A错误;
B.在y点再通入0.05 mol HCl气体,溶液中CH3COONa 和CH3COOH等物质的量混合,因溶液显酸性,说明CH3COOH电离大于CH3COO水解,溶液中离子浓度大小比较关系是c(CH3COO-) >c(Na+) =c(Cl-) > c(H+) >c(OH-),故B错误;C.y点形成了缓冲溶液, 在溶液中加入一滴强酸抑制电离CH3COOH、加入一滴强碱抑制CH3COO-水解,溶液pH变化最小,故C正确;D.y点的溶液中存在CH3COOH![]() CH3COO-+H+ ,溶液中c(CH3COOH) 和c(CH3COO-) 近似相等,CH3COOH的Ka=[c(CH3COO-)×c(H+) ]÷c(CH3COOH) =10-4.75,故D错误;答案为C。
CH3COO-+H+ ,溶液中c(CH3COOH) 和c(CH3COO-) 近似相等,CH3COOH的Ka=[c(CH3COO-)×c(H+) ]÷c(CH3COOH) =10-4.75,故D错误;答案为C。

练习册系列答案
相关题目