题目内容
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)E的元素符号为__________,E、F的离子半径最小的是____(填离子符号);
(2)A、C、D三种元素组成的一种常见化合物,是氯碱工业的重要的产品,该化合物电子式为__________。
(3)B、C最简单的氢化物的稳定性最强的是__________(填分子式)。
(4)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为___________。B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:______________。
【答案】 S Cl- ![]() H2O NCl3 NCl5+3H2O=HNO3+5HCl
H2O NCl3 NCl5+3H2O=HNO3+5HCl
【解析】试题分析:A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,所以A是H元素、C是O元素;A、B的最外层电子数之和与C的
最外层电子数相等,所以B是N元素; A、D同主族,所以D是Na元素;C与E同主族,所以E是S元素;D、E、F同周期,原子序数依次增大,所以F是Cl元素。
解析:根据以上分析,(1)E的元素符号为S,电子层数相同时,质子数越多半径越小,半径S2->Cl-,半径最小的是Cl-;
(2)氯碱工业的重要的产品是氢氧化钠,氢氧化钠的电子式为![]() 。
。
(3)N的非金属性小于O,NH3的稳定性低于H2O,稳定性最强的是H2O。
(4)N与Cl两种元素形成的一种化合物分子,各原子均达8电子结构,该化合物化学式为NCl3。N与Cl两种元素还能形成另一种化合物,其中B显最高正价,该化合物是NCl5,与水反应生成硝酸和盐酸,反应的化学方程式:NCl5+3H2O=HNO3+5HCl;

 名校课堂系列答案
名校课堂系列答案【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如下:

有关物质的溶度积常数
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+= Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为________。
(2)流程中,FeSO4的作用是_______,MnO的作用是_________,当滤液中的pH为6时,滤液中所含铝离子的浓度为___________。
(3)采用下图装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为________;电解产生的MnO2沉积在电极上,该电极反应式为_________。
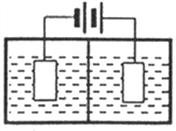
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出。则Fe2+与矿浆中MnO2反应的离子方程式为__________。
(5)写出高温煅烧生成锰酸锂的化学方程式___________。