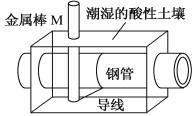
题目内容
【题目】已知硼、氮、钴、铜是几种重要的元素,请回答下列向题:
(1)Co的基态原子中未成对电子数为________个;Cu的基态原子的电子排布式为_______。
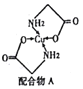
(2)Cu的配合物A的结构如右图,A中所含C、N、O三种元素的第一电离能由大到小的顺序为________。其中氮原子的杂化方式是_______________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2 和N2, N2中δ键和π键数目之比是________;N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为________。
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。

①晶胞中每个氮原子周围与其最近且等距离的硼原子有________个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化翻的晶胞中,B原子的坐标参数分别有:B (0,0,0);B(![]() ,0,
,0, ![]() );B (
);B (![]() ,(
,(![]() ,
, ![]() ,0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为_________;
,0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为_________;
③已知氮化硼晶胞边长为apm,则氮化硼的密度为_______g·cm -3(设NA为阿伏加德罗常数值,只要求列算式)。
【答案】 3 1s22s22p63s23p63d104s1 或[Ar] 3d104s1 N>O>C sp3杂化 l : 2 ![]() 4 (l/4, l/4, l/4,)
4 (l/4, l/4, l/4,) ![]()
【解析】(1)Co的核电荷数为27,其价层电子排布式为3d74s2,其基态原子中未成对电子数为3个;Cu原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p63d104s1 或[Ar] 3d104s1 ;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是N>O>C;N原子价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化方式为sp3;
(3)N2中σ键和π键数目之比为1:2,等电子体结构相似,根据二氧化碳电子式书写N2O的电子式为![]() ;
;
(4)①晶胞中每个氮原子周围与其最近且等距离的硼原子形成正四面体结构,硼原子数目为4;
②该晶胞中N原子个数是4、B原子个数=8×![]() +6×
+6×![]() =4,则B-N键个数为12,距离上述三个B原子最近且等距的N原子的坐标参数为(
=4,则B-N键个数为12,距离上述三个B原子最近且等距的N原子的坐标参数为(![]() 、
、![]() 、
、![]() );
);
③晶胞的体积为(a×10-10cm)3,晶胞的质量为![]() g,则氮化硼的密度为
g,则氮化硼的密度为![]() g÷(a×10-10cm)3=
g÷(a×10-10cm)3=![]() g·cm -3。
g·cm -3。