题目内容
【题目】光卤石是制取钾肥的重要原料,也是提炼金属镁的重要原料。纯净的光卤石的组成可表示为KCl·MgCl2·nH2O。某化学小组为了测定纯净的光卤石的组成,进行如下实验:
实验l:用下图所示装置测定纯净的光卤石中结晶水的含量。

(1)装置A的作用是______________________。装置B中的试剂是___________。装置D的作用是______________________。
(2)实验步骤包括:
①点燃装置C处的酒精灯
②打开装置A处的分液漏斗的活塞
③组装仪器,并检查装置的气密性
④装入药品
⑤关闭装置A处的分液漏斗的活塞
⑥熄灭装置C处的酒精灯
上述实验步骤的先后顺序为______________________(填序号)。
(3)写出装置C中硬质玻璃管内发生反应的化学方程式:___________________________(光卤石用“KCl·MgCl2·nH2O”表示)。
(4)若装置C中硬质玻璃管的质量为a g,实验前称量得硬质玻璃管和样品的总质量为b g,充分反应并冷却后,称量得硬质玻璃管和剩余固体的总质量为c g。则KCl·MgCl2·nH2O 中n=___________ (用含a、b、c的代数式表示)。
实验Ⅱ:测定纯净的光卤石中Mg2+的质量分数。
取wg纯净的光卤石溶于适当过量的稀硝酸中,再用水稀释,配制成250 mL溶液。取25.00 mL所配制的溶液于锥形瓶中,滴几滴K2CrO4溶液(作指示剂),用c mol·L1AgNO3标准溶液滴定至终点,消耗AgNO3标准溶液V mL。
(5)纯净的光卤石中所含Mg2+的质量分数为___________%(用含w、c、V的代数式表示)。
(6)若滴定开始时仰视读数,滴定终点时俯视读数,则测得的结果会___________(填“偏高”“偏低”或“无影响”)。
【答案】制取HCl气体 浓硫酸 吸收尾气中的氯化氢、水蒸气及空气中的水蒸气 ③④②①⑥⑤ KCl·MgCl2·nH2O![]() KCl+MgCl2+nH2O↑
KCl+MgCl2+nH2O↑ ![]()
![]() 偏低
偏低
【解析】
(1)浓硫酸溶于水放热,可使浓盐酸挥发出HCl气体;气体进入硬质玻璃管之间需干燥,装置D的目的是为防止外界空气进入装置,据此作答;
(2)实验操作步骤分为准备阶段、进行阶段及结束阶段;
(3)在硬质玻璃管内,HCl气流中光卤石发生分解;
(4)根据差量法列式计算;
(5)根据元素守恒法和关系式法找出氯离子的物质的量,进而求得镁离子的物质的量,得出表达式;
(6)结合上述表达式,依据标准滴定操作的不当对标准液读取体积的影响分析作答。
(1)装置A的作用是制取氯化氢。装置B中盛有浓硫酸,用于干燥氯化氢。装置D中的碱石灰可吸收尾气中的氯化氢、水蒸气以及空气中的水蒸气,
故答案为:制取HCl气体;浓硫酸;吸收尾气中的氯化氢、水蒸气及空气中的水蒸气;
(2)实验准备阶段:组装仪器并检查装置气密性,装药品。
实验进行阶段:打开A处分液漏斗的活塞,通HCl气体赶尽装置内的空气,点燃C处的酒精灯,使样品在HCl的气氛中失去结晶水。
实验结束阶段:停止加热,继续通HCl气体,待硬质玻璃管冷却至室温后,关闭分液漏斗的活塞,停止通入HCl气体。故实验步骤为③④②①⑥⑤,
故答案为:③④②①⑥⑤;
(3)光卤石在氯化氢气氛中的脱水反应为KCl·MgCl2·nH2O![]() KCl+MgCl2+nH2O↑,
KCl+MgCl2+nH2O↑,
故答案为:KCl·MgCl2·nH2O![]() KCl+MgCl2+nH2O↑;
KCl+MgCl2+nH2O↑;
(4)依题意,无水KCl和MgCl2的总质量为(ca) g,结晶水的质量为(bc)g。
由化学方程式KCl·MgCl2·nH2O![]() KCl+MgCl2+nH2O↑可得
KCl+MgCl2+nH2O↑可得![]() ,解得n=
,解得n=![]() ,
,
故答案为:![]() 。
。
(5)w g纯净的光卤石中,n(Cl) = n(AgCl) = n(AgNO3) = ![]() ,由KCl·MgCl2·nH2O可知,n(Mg2+)=
,由KCl·MgCl2·nH2O可知,n(Mg2+)=![]() ,所以纯净的光卤石中所含Mg2+的质量分数为
,所以纯净的光卤石中所含Mg2+的质量分数为![]() ,
,
故答案为:![]() ;
;
(6)若滴定开始时仰视读数,滴定终点时俯视读数,则读取的AgNO3标准溶液体积V偏小,根据上述所含Mg2+的质量分数表达式为![]() 可以看出,会使最终结果偏低,
可以看出,会使最终结果偏低,
故答案为:偏低。

【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ | 克劳斯法 |
|
Ⅱ | 铁盐氧化法 |
|
Ⅲ | 光分解法 |
|
① 反应Ⅰ的化学方程式是________。
② 反应Ⅱ:____+ 1 H2S ==____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。
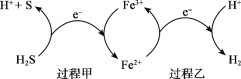
过程甲、乙中,氧化剂分别是______。
(3)按照设计,科研人员研究如下。
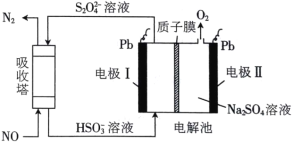
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:

ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。

进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________。
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。