题目内容
【题目】以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
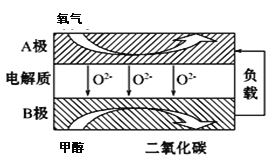
(1)B极上的电极反应式为 。
(2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲醇的质量为 克,若要使溶液复原,可向电解后的溶液中加入的物质有 。
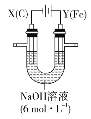
(3)目前已开发出用电解法制取ClO2的新工艺。
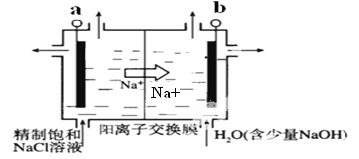
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的 极( 填A或B) ,写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
【答案】
(1)CH3OH-6e-+O2- =CO2+4H+
(2)10.67 CuO或CuCO3
(3)①A 2H2O+Cl--5e-=ClO2+4H+ ②0.01
【解析】
试题分析:
(1)燃料电池中负极通燃料,发生氧化反应,正极通氧气,发生还原反应。所以负极上甲醇失去电子结合氧离子形成二氧化碳和水,正极上氧气得到电子形成氧负离子。则负极B极上的电极反应式为CH3OH-6e-+O2- =CO2+4H+。
(2)用石墨做电极电解硫酸铜溶液时,阳极电极反应为:4OH--4e-= O2 + 2H2O;当阳极收集到11.2L(标准状况)气体时,即0.5mol O2,需转移电子2mol。1mol 甲醇反应转移6mol电子,则消耗甲醇的质量为![]() mol×32g/mol=10.67g。若要使溶液复原,可向电解后的溶液中加入CuO或CuCO3。
mol×32g/mol=10.67g。若要使溶液复原,可向电解后的溶液中加入CuO或CuCO3。
(3)①示意图中Na+从左到右,则可判断电极a为阳极,需接电源的正极,即接甲醇燃料电池的A极。该装置的目的是制备ClO2,则ClO2在阳极产生,电极反应式为Cl--5e-+2H2O=ClO2+4H+。
②水电离产生的H+在阴极上放电产生氢气,转移电子的物质的量n=2n(H2)=2×(0.112 L÷22.4 L·mol-1)=0.01 mol,则在内电路中移动的电荷为0.01 mol,每个Na+带一个单位的正电荷,则通过阳离子交换膜的阳离子Na+为0.01 mol。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案