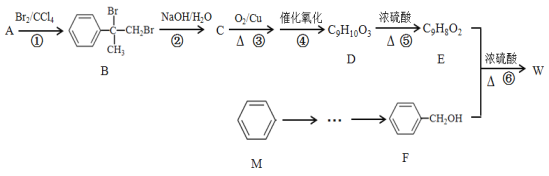
题目内容
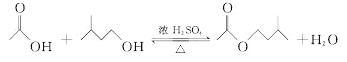
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
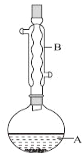
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是_______________。
(2)在洗涤操作中,第一次水洗的主要目的是___________,第二次水洗的目的是______________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_____________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是。
(5)实验中加入少量无水![]() 的目的是_________________。
的目的是_________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是__________(填标号)。
a. 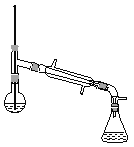 b.
b. 
c.  d.
d. 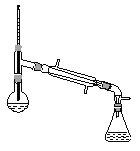
(7)本实验的产率是___________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏___________(填“高”或“低”),其原因是____________________。
【答案】球形冷凝管 洗掉大部分硫酸和醋酸 洗掉碳酸氢钠 d 提高醇的转化率 干燥 b c 高会收集少量未反应的异戊醇
【解析】
(1)根据题中仪器B的构造判断该仪器的名称;
(2)在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)根据乙酸异戊酯的密度及正确的分液操作方法进行解答;
(4)根据反应中,增加一种反应物的浓度,可以使另一种反应物的转化率提高进行判断加入过量乙酸的目的;
(5)少量无水硫酸镁能够吸收乙酸异戊酯中少量的水分,起到干燥作用;
(6)先根据温度计在蒸馏操作中的作用排除ad,再根据球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,得出正确结论;
(7)先计算出乙酸和异戊醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成乙酸异戊酯的物质的量,最后根据实际上制取的乙酸异戊酯计算出产率;
(8)若从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,导致获得的乙酸异戊酯质量偏大。
(1)由装置中仪器B的构造可以知道,仪器B的名称为球形冷凝管;
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;用饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)因为酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d;
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动,增加一种反应物的浓度,可以使另一种反应物的转化率提高;因此本实验中加入过量乙酸的目的是提高转化率;
(5)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对其进行干燥;
(6)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b;故正确答案是b;
(7)乙酸的物质的量为![]() =0.1mol,异戊醇的物质的量为
=0.1mol,异戊醇的物质的量为![]() =0.05mol,因为乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为
=0.05mol,因为乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为![]() =0.03mol,所以实验中乙酸异戊酯的产率为:
=0.03mol,所以实验中乙酸异戊酯的产率为:![]() ×100%=60%,答案选c;
×100%=60%,答案选c;
(8)在进行蒸馏操作时,若从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,因此会导致产率偏高。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】重铬酸钠(Na2Cr2O72H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeOCr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
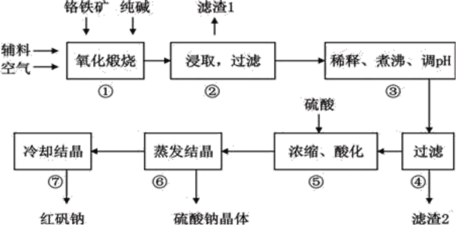
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是__________________;
(2)③中调节pH至4.7,目的是__________________;
(3)⑤中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:__________________;
(4)⑦中采用冷却结晶的方法析出红矾钠,依据是_________________________ ;
(5)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__________________mol·L-1,后续废水处理方能达到排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO47H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。
Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO47H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。