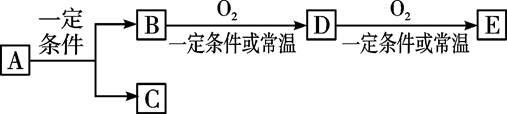
题目内容
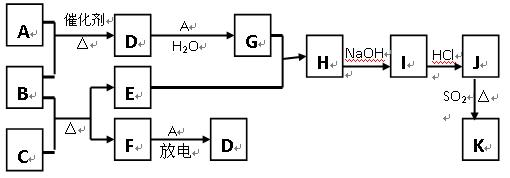
(15分)A、B、C、D四种均为短周期元素,原子序数依次增大
(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M,M可以使溴水褪色。
(2)A元素的单质和C元素的单质化合可生成Z, Z在加热条件下跟水反应的产物1 mol需用3mol KOH才能完全中和。
(3)A元素的单质和B元素的单质一定条件下反应生成化合物N,D元素的单质和B元素的单质反应生成化合物G,化合物N和化合物G的相对分子质量相等,且焰色反应均呈黄色。
回答下列问题:
(1)画出元素D的离子结构示意图: ;
(2)A、B、C、D四种元素的原子半径按由小到大排列的顺序为(用相应的元素符号表示):
(3)M可以使溴水褪色,写出该反应的离子方程式 ;
(4)Z与热水反应的化学方程式 。
(5)化合物N与化合物G的水溶液反应,若氧化剂与还原剂物质的量之比为1:1,该反应的离子方程式为
(6)常温下,D的氢化物呈气态,有毒,水溶液呈酸性。脱除天然气中D的氢化物既能减少环境污染,又可回收D的单质。用过量NaOH溶液吸收D的氢化物后,以石墨作电极电解该溶液可回收D的单质,其电解总反应的化学方程式(忽略溶解氧的氧化还原反应)为 ;
该方法的优点是 。
(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M,M可以使溴水褪色。
(2)A元素的单质和C元素的单质化合可生成Z, Z在加热条件下跟水反应的产物1 mol需用3mol KOH才能完全中和。
(3)A元素的单质和B元素的单质一定条件下反应生成化合物N,D元素的单质和B元素的单质反应生成化合物G,化合物N和化合物G的相对分子质量相等,且焰色反应均呈黄色。
回答下列问题:
(1)画出元素D的离子结构示意图: ;
(2)A、B、C、D四种元素的原子半径按由小到大排列的顺序为(用相应的元素符号表示):
(3)M可以使溴水褪色,写出该反应的离子方程式 ;
(4)Z与热水反应的化学方程式 。
(5)化合物N与化合物G的水溶液反应,若氧化剂与还原剂物质的量之比为1:1,该反应的离子方程式为
(6)常温下,D的氢化物呈气态,有毒,水溶液呈酸性。脱除天然气中D的氢化物既能减少环境污染,又可回收D的单质。用过量NaOH溶液吸收D的氢化物后,以石墨作电极电解该溶液可回收D的单质,其电解总反应的化学方程式(忽略溶解氧的氧化还原反应)为 ;
该方法的优点是 。
(1) 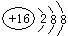 (1分); (2)O<S <P< Na (2分)
(1分); (2)O<S <P< Na (2分)
(3)H2SO3 + Br2 + H2O = 4H+ + SO42- + 2Br- (2分)
(4)P2O5+3H2O(热)=2H3PO4 (2分)
(5)Na2O2 + S2- + 2H2O = 2Na+ + S + 4OH- (3分)
(6)Na2S + 2H2O S↓+ H2↑+ 2NaOH(3分)
S↓+ H2↑+ 2NaOH(3分)
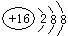 (1分); (2)O<S <P< Na (2分)
(1分); (2)O<S <P< Na (2分)(3)H2SO3 + Br2 + H2O = 4H+ + SO42- + 2Br- (2分)
(4)P2O5+3H2O(热)=2H3PO4 (2分)
(5)Na2O2 + S2- + 2H2O = 2Na+ + S + 4OH- (3分)
(6)Na2S + 2H2O
 S↓+ H2↑+ 2NaOH(3分)
S↓+ H2↑+ 2NaOH(3分)生成的NaOH可循环利用,副产氢气可以作为化工原料或燃料 (2分)
由(1)知A、D分别为O、S,形成的化合物X和Y分别为SO2与SO3、M为H2SO3;由(2)知C元素为P、Z是P2O5;由(3)知B为Na,化合物N、G分别是Na2O2、Na2S。然后利用元素周期律和有关物质的性质可顺利的解答有关问题。
由(1)知A、D分别为O、S,形成的化合物X和Y分别为SO2与SO3、M为H2SO3;由(2)知C元素为P、Z是P2O5;由(3)知B为Na,化合物N、G分别是Na2O2、Na2S。然后利用元素周期律和有关物质的性质可顺利的解答有关问题。

练习册系列答案
相关题目