题目内容
【题目】磷酸二氢钾在工农业和医学领域具有广泛的应用。以下是工业上制备磷酸二氢钾的三种方法。回答下列问题:
Ⅰ.直接法

(1)“转化”步骤发生反应的离子反应方程式___(已知:Ca3(PO4)2难溶于水)。
(2)“操作Ⅰ”是___。
Ⅱ.酸碱中和法
(3)氢氧化钾溶液与高纯度磷酸在反应器中发生中和反应制备磷酸二氢钾。
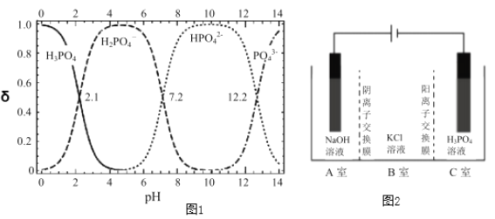
①由图1判断制备磷酸二氢钾(达80%)的最佳pH范围___。
②K2HPO4溶液呈___性(填“酸”、“碱”、“中”)。
Ⅲ.电解法
电解法制取KH2PO4的原理如图2所示。一定件下,还可得到NaClO3。
(4)在___室(填标号)可得到KH2PO4;写出产生ClO3-的电极反应式___。
【答案】Ca3(PO4)2+4H++3SO42-![]() 2H2PO4-+3CaSO4 蒸馏 3~6.5 碱 C Cl-+6OH-﹣6e-=ClO3-+3H2O
2H2PO4-+3CaSO4 蒸馏 3~6.5 碱 C Cl-+6OH-﹣6e-=ClO3-+3H2O
【解析】
(1)由流程可知KHSO4溶液加入Ca3(PO4)270℃可以转化得到KH2PO4,另一物质为CaSO4,据此书写;
(2)蒸馏用来分离易挥发和难挥发的物质,据此分析;
(3)①根据图中H2PO4-含量超过80%的点进行解答;
②K2HPO4溶液中含磷元素最多的微粒为HPO42-;
(4)C室连接电源负极得到电子做阴极,阳离子钾离子通过阳离子交换膜进入C室,得到产品磷酸二氢钾,氯离子通过阴离子交换膜在A室失去电子发生氧化反应,据此分析;
(1)由流程可知KHSO4溶液加入Ca3(PO4)270℃可以转化得到KH2PO4,另一物质为CaSO4,离子方程式为:Ca3(PO4)2+4H++3SO42-![]() 2H2PO4-+3CaSO4;
2H2PO4-+3CaSO4;
(2)经过操作Ⅰ得到易挥发的甲醇和电解质溶液,经过蒸馏可得,故答案为:蒸馏;
(3)①图象分析可知判断制备磷酸二氢钾(达80%)的最佳pH范围:3-6.5;
②根据图像可以看出当溶液中主要为HPO42-时溶液显碱性;
(4)C室连接电源负极得到电子做阴极,阳离子钾离子通过阳离子交换膜进入C室,得到产品磷酸二氢钾,氯离子通过阴离子交换膜在A室失去电子发生氧化反应得到ClO3-,电极反应式为:Cl-+6OH--6e-=ClO3-+3H2O;

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案