题目内容
加热蒸干以下物质的溶液,不能析出原溶质固体的是
| A.Fe2(SO4)3 | B.FeCl3 | C.Na2CO3 | D.KCl |
B
试题分析:氯化铁在溶液中存在水解平衡,加热促进水解,且生成的氯化氢易挥发,进一步促进水解平衡向生成氢氧化铁的方向移动,所以最终生成的是氢氧化铁固体,得不到氯化铁。由于硫酸是难挥发性酸,所以最终仍然得到硫酸铁。其余选项均可以得到原溶质,答案选B。
点评:该题是中等难度的试题,主要是考查学生对水解平衡的了解掌握程度以及外界条件是如何影响盐类水解的,有助于巩固学生的基础性知识,也有利于培养学生灵活运用基础知识解决实际问题的能力。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
 Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是
Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是  Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
 )的增大而减小
)的增大而减小
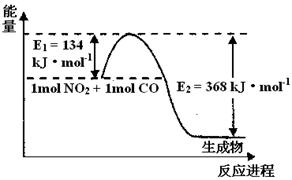
 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。