题目内容
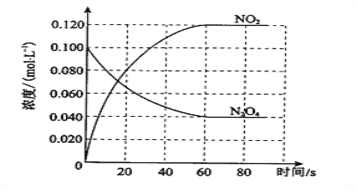
【题目】恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_____________。
(2)x=________。
(3)下列各项可作为该反应达到平衡状态的标志是_________(填字母)。
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2:1
【答案】0.6mol·(L·min)-1 3 BC
【解析】
(1)根据反应速率![]() =
=![]() 公式计算。
公式计算。
(2)根据反应物和生成物的浓度变化量之比等于对应物质的化学计量数之比计算。
(3)根据化学平衡状态的特征分析。
(1)依题意,C的初始浓度为0,平衡浓度为1.2mol/L,所以生成C的平均反应速率=![]() =0.6mol/(L·min)。
=0.6mol/(L·min)。
(2)参加反应的B气体浓度△c(B)=![]() =0.4mol/L,生成的C气体浓度△c(C)=1.2mol/L,则有△c(B):△c(C)=1:x,即0.4mol/L:1.2mol/L=1:x,解得x=3。
=0.4mol/L,生成的C气体浓度△c(C)=1.2mol/L,则有△c(B):△c(C)=1:x,即0.4mol/L:1.2mol/L=1:x,解得x=3。
(3)A. 反应2A(g)+B(g)![]() 3C(g)+2D(s)中气体分子数不变,在温度和容积不变时,气体压强与气体分子数成正比,所以该反应过程中压强一直没有变化,所以压强不再变化不能作为该反应达到平衡状态的标志,A项错误;B.由于该反应中存在气体与固体相互转化,当容积不变时,由密度ρ=
3C(g)+2D(s)中气体分子数不变,在温度和容积不变时,气体压强与气体分子数成正比,所以该反应过程中压强一直没有变化,所以压强不再变化不能作为该反应达到平衡状态的标志,A项错误;B.由于该反应中存在气体与固体相互转化,当容积不变时,由密度ρ=![]() 公式知,在反应过程中气体的密度一直在变化,当达到平衡时密度才不变,所以气体密度不再变化可作为该反应达到平衡状态的标志,B项正确;C. 由于该反应中存在气体与固体相互转化,故气体的质量一直在变化,且气体物质的量不变,根据平均摩尔质量(数值与相对分子质量相等)M=
公式知,在反应过程中气体的密度一直在变化,当达到平衡时密度才不变,所以气体密度不再变化可作为该反应达到平衡状态的标志,B项正确;C. 由于该反应中存在气体与固体相互转化,故气体的质量一直在变化,且气体物质的量不变,根据平均摩尔质量(数值与相对分子质量相等)M=![]() 可知,在反应过程中气体平均相对分子质量一直在变化,只有达到平衡时才不变化,所以平均相对分子质量不再变化可作为该反应达到平衡状态的标志,C项正确;D.无论反应是否达到平衡状态,A的消耗速率与B的消耗速率之比恒为2:1。综上所述,答案选BC。
可知,在反应过程中气体平均相对分子质量一直在变化,只有达到平衡时才不变化,所以平均相对分子质量不再变化可作为该反应达到平衡状态的标志,C项正确;D.无论反应是否达到平衡状态,A的消耗速率与B的消耗速率之比恒为2:1。综上所述,答案选BC。