题目内容
(12分)“神州”六号飞船上使用是氢氧燃料电池,其电池总反应式为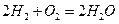
试完成下列问题:
(1) 若电解溶液为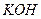 溶液,则电极反应式为:
溶液,则电极反应式为:
负极:
正极:
(2)如果把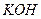 改为稀硫酸做导电物质,则电极反应式为:
改为稀硫酸做导电物质,则电极反应式为:
负极:
正极:
(3)如果把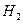 改为
改为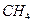 ,
,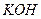 溶液作导电物质,则电极反应式为:
溶液作导电物质,则电极反应式为:
负极:
正极:
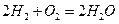
试完成下列问题:
(1) 若电解溶液为
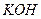 溶液,则电极反应式为:
溶液,则电极反应式为:负极:
正极:
(2)如果把
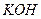 改为稀硫酸做导电物质,则电极反应式为:
改为稀硫酸做导电物质,则电极反应式为:负极:
正极:
(3)如果把
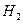 改为
改为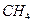 ,
,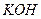 溶液作导电物质,则电极反应式为:
溶液作导电物质,则电极反应式为:负极:
正极:
(1) 2H2+4OH—-4e-=4H2O; O2+2H2O+4e-=4OH-.(2)2H2-4e-=4H+;O2+4H++4e-=2H2O;(3)CH4+10OH—+8e-=CO32-+7H2O,O2+H2O+4e-=4OH-。
本题考查电极方程式的书写;解决此题的关键是弄清原电池的有关要领,根据电池反应式可知,H2在反应中被氧化,O2被还原,H2在负极上反应,O2在正极上反应。又因为是碱性溶液不可能有H+参加或生成,故负极反应式为2H2+4OH—-4e-=4H2O,正极反应为O2+2H2O+4e-=4OH-.;若将导电物质换成酸性溶液,此时应考虑不可能有OH-参加反应,也不可能有OH-生成,负极2H2-4e-=4H+,正极: O2+4H++4e-=2H2O;如把H2改为CH4,用KOH作导电物质,则负极:CH4+10OH—+8e-=CO32-+7H2O,正极:O2+H2O+4e-=4OH-。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2PbSO4+2H2O 下列叙述正确的是( )
2PbSO4+2H2O 下列叙述正确的是( ) Fe(OH)2 + Ni(OH)2关于此蓄电池有下列说法:
Fe(OH)2 + Ni(OH)2关于此蓄电池有下列说法: 为正极;
为正极; ;
; +2e-;
+2e-;

 Li2S2O4。下列说法正确的是( )
Li2S2O4。下列说法正确的是( )