题目内容
2.(1)C、N、O三种元素的电负性由大到小的顺序是O>N>C,元素的第一电离能由大到小的顺序是N>O>C.(2)C、N两种元素的简单气态氢化物的热稳定性由强到弱的顺序为NH3>CH4(填化学式).CH2=CH-C≡CH分子中的σ键与π键的键数之比为7:3.
分析 (1)原子的得电子能力越强,其电负性的数值越大;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(2)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定;根据共价单键为σ,共价双键中一个是σ一个是π键,共价三键中一个是σ两个是π键计算.
解答 解:(1)元素原子的得电子能力越强,则电负性越大,所以O>N>C;
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O>C,故答案为:O>N>C;N>O>C;
(2)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定,N元素的非金属性大于C元素,所以氢化物的稳定性NH3>CH4,共价单键为σ,共价双键中一个是σ一个是π键,共价三键中一个是σ两个是π键,所以CH2=CH-C≡CH分子中的σ键与π键的键数之比7:3,故答案为:NH3>CH4;7:3.
点评 本题考查了物质结构和性质,涉及电负性、第一电离能、氢化物的稳定性等知识点,这些知识点都是考试热点,要熟练掌握这些知识点,难度中等.

练习册系列答案
相关题目
12.下列说法错误的是( )
| A. | 正丁烷和异丁烷的熔点、沸点各不相同 | |
| B. | 乙醛和丙烯醛(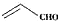 )与H2充分反应后的产物是同系物 )与H2充分反应后的产物是同系物 | |
| C. | 某有机物燃烧生成等物质的量的CO2和H2O,该有机物的通式一定为CnH2n | |
| D. | 用质谱法测定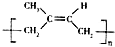 的平均相对分子质量,可得其聚合度 的平均相对分子质量,可得其聚合度 |
13.下列反应所得的有机产物只有一种的是( )
| A. | 等体积的甲烷与氯气在光照条件下的取代反应 | |
| B. | 丙烯与氯化氢的加成反应 | |
| C. | CH3-CH(OH)-CH3在浓硫酸作用下的消去反应 | |
| D. | 甲苯与液溴在溴化铁做催化剂条件下的取代反应 |
10.下列说法正确的是( )
| A. | 需要加热的化学反应都是不自发反应 | |
| B. | 中和反应都是放热反应 | |
| C. | 原电池是将电能转化为化学能的一种装置 | |
| D. | 太阳能电池是将化学能转化为电能的过程 |
17.据报道,反式脂肪酸目前被广泛添加于加工食品中,而反式脂肪酸会导致心脏病和糖尿病等疾病.已知某种反式脂肪酸的结构简式为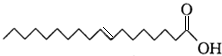 ,下列判断不正确的是( )
,下列判断不正确的是( )
 ,下列判断不正确的是( )
,下列判断不正确的是( )| A. | 该物质与丙烯酸互为同系物 | |
| B. | 该物质的分子式为C18H34O2 | |
| C. | 该物质易溶于水,在空气中不易变质 | |
| D. | 该物质的碳链含有锯齿形结构 |
11.下列说法中错误的是( )
| A. | 0.5 L 2 mol•L-1 AlCl3溶液中,Al3+和Cl-总数小于4×6.02×1023个 | |
| B. | 制成0.5 L 10 mol•L-1的盐酸,需要标准状况下的氯化氢气体112 L | |
| C. | 从1 L 1 mol•L-1的NaCl溶液中移取出10 mL溶液,其浓度是1 mol•L-1 | |
| D. | 10 g 98%的硫酸(密度为1.84 g•cm-3)与10 mL18.4 mol•L-1的硫酸的浓度不同 |

 ,D
,D .
.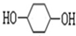 的路线如下所示,请按要求作答:
的路线如下所示,请按要求作答:
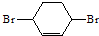 )
)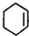 ,F
,F .
.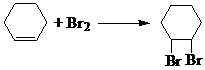 ;④
;④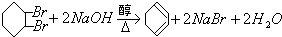 .
.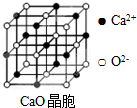 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: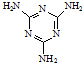 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.