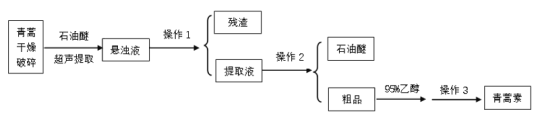
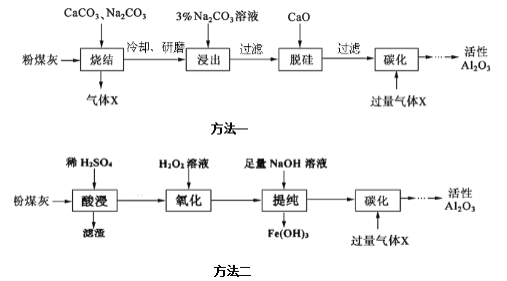
题目内容
【题目】铝和氢氧化钠都是重要的工业产品。请回答:
(1)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如图所示。
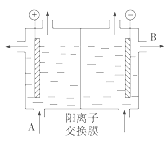
①请写出A、B两处物质的名称或化学式:A__、B__。
②请写出电解食盐水制烧碱的离子方程式__。
(2)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如图。
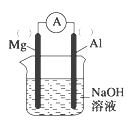
①负极材料为__(填Mg或Al)。
②该原电池的总反应式为__。
【答案】浓NaCl溶液(饱和食盐水也可) 浓NaOH溶液 2Clˉ+2H2O![]() 2OHˉ+H2↑+Cl2↑ Al 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2OHˉ+H2↑+Cl2↑ Al 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】
(1)电解饱和食盐水制NaOH阳极氯离子放电生成氯气,阴极水电离出的氢离子放电生成氢气,同时产生氢氧根,据图可知左侧为电解池阳极,所以A应为浓NaCl溶液,钠离子经阳离子交换膜进入阴极,所以B为浓NaOH溶液;
(2)铝可以和NaOH溶液反应,而Mg不行,所以电池总反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
(1)①根据分析可知A为浓NaCl溶液,B为浓NaOH溶液;
②电解食盐水制烧碱的离子方程式为2Clˉ+2H2O![]() 2OHˉ+H2↑+Cl2↑;
2OHˉ+H2↑+Cl2↑;
(2)①电池总反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al失电子被氧化,所以Al为负极;
②电池总反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。

【题目】(Ⅰ)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为___;
H2(g)+I2(g)的平衡常数K2为___;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)C(H2)=c(CO)c(H2O),判断此时温度为___℃。