题目内容
在100℃时,将2.00mol的二氧化氮气体充入2L真空的密闭容器中,发生反应2NO2?N2O4,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
(1)在上述条件下,从反应开始至20s 时,v(NO2)= mol/(L?s).
(2)100℃时,该反应的平衡常数为 .
(3)达到平衡后,如升温,气体颜色变深,则反应2NO2?N2O4的△H 0(填“>”或“<”).
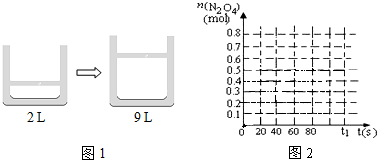
(4)保持温度不变,在80s时,若将密闭容器的体积由2L扩大到9L(如图1所示),反应2NO2?N2O4
在t1 s时重新达到平衡,测得 n(N2O4)= mol,请在图2中画出0~t1s这一过程的变化曲线.
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 2.00 | n1 | 1.25 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.20 | n2 | 0.50 | 0.50 |
(2)100℃时,该反应的平衡常数为
(3)达到平衡后,如升温,气体颜色变深,则反应2NO2?N2O4的△H
(4)保持温度不变,在80s时,若将密闭容器的体积由2L扩大到9L(如图1所示),反应2NO2?N2O4
在t1 s时重新达到平衡,测得 n(N2O4)=

考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)先计算四氧化二氮的平均反应速率,再根据同一可逆反应中,同一时间段内,各物质的反应速率之比等于其计量数之比计算二氧化氮的平均反应速率;
(2)根据K=
进行计算;
(3)升温,气体颜色变深,说明平衡向生成二氧化氮方向移动,所以2NO2 N2O4 为放热反应,据此答题;
N2O4 为放热反应,据此答题;
(4)根据平衡常数,利用三段式进行计算,根据四氧化二氮的物质的量的变化可以画图.
(2)根据K=
| c(N2O4) |
| c2(NO2) |
(3)升温,气体颜色变深,说明平衡向生成二氧化氮方向移动,所以2NO2
 N2O4 为放热反应,据此答题;
N2O4 为放热反应,据此答题;(4)根据平衡常数,利用三段式进行计算,根据四氧化二氮的物质的量的变化可以画图.
解答:
解:(1)c(N2O4)=
=0.005mol/(L.s),同一可逆反应中,同一时间段内,各物质的反应速率之比等于其计量数之比,所以二氧化氮的平均反应速率为0.01 mol?L-1?S-1,故答案为:0.01 mol?L-1?S-1;
(2)2NO2 N2O4
N2O4
起始浓度(mol?L-1) 1.0 0
转化浓度(mol?L-1) 0.5 0.25
平衡浓度(mol?L-1) 0.5 0.25
∴K=
=
=1
故答案为:1;
(3)升温,气体颜色变深,说明平衡向生成二氧化氮方向移动,所以2NO2 ?N2O4 为放热反应,故△H<0,故答案为:<;
?N2O4 为放热反应,故△H<0,故答案为:<;
(4)设平衡后得n(N2O4)为xmol
2NO2 N2O4
N2O4
起始浓度(mol?L-1)
0
转化浓度(mol?L-1)
平衡浓度(mol?L-1)
-
∵k=
=
=1∴解得x=0.25或x=4;其中x=4不符合实际,故N2O4的物质的量为0.25;
根据表中N2O4的物质的量及体积变为9L后N2O4的物质的量,可以画出图为: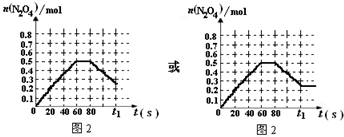 ,
,
故答案为:0.25; .
.
| ||
| 20s |
(2)2NO2
 N2O4
N2O4 起始浓度(mol?L-1) 1.0 0
转化浓度(mol?L-1) 0.5 0.25
平衡浓度(mol?L-1) 0.5 0.25
∴K=
| c(N2O4) |
| c2(NO2) |
| 0.25 |
| 0.52 |
故答案为:1;
(3)升温,气体颜色变深,说明平衡向生成二氧化氮方向移动,所以2NO2
 ?N2O4 为放热反应,故△H<0,故答案为:<;
?N2O4 为放热反应,故△H<0,故答案为:<;(4)设平衡后得n(N2O4)为xmol
2NO2
 N2O4
N2O4 起始浓度(mol?L-1)
| 2 |
| 9 |
转化浓度(mol?L-1)
| 2x |
| 9 |
| x |
| 9 |
平衡浓度(mol?L-1)
| 2 |
| 9 |
| 2x |
| 9 |
| x |
| 9 |
∵k=
| c(N2O4) |
| c2(NO2) |
| ||||
(
|
根据表中N2O4的物质的量及体积变为9L后N2O4的物质的量,可以画出图为:
 ,
,故答案为:0.25;
 .
.
点评:本题主要考查了反应速率的计算、化学平衡常数的计算及应用,难度中等,解题时要注意灵活运用化学平衡常数.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
以下实验操作错误的是( )
| A、给试管里的固体加热时,试管口略向下倾斜 |
| B、给烧瓶里的液体加热时,垫上石棉网 |
| C、用燃着的酒精灯去点燃另一个酒精灯 |
| D、用托盘天平称量固体的质量时,砝码放在右盘 |
“盖中盖”、“盖天力”等广告几乎无人不知,作为一种补钙剂,其中所含有的有效成分主要是“葡萄糖酸钙”,“葡萄糖酸钙”的化学式应为( )
| A、(C6H12O7)2Ca |
| B、(C6H11O7)2Ca |
| C、(C6H12O6)2Ca |
| D、(C6H12O8)2Ca |
已知氧化性Cl2>Br2>I2,向NaI和NaBr的混合溶液中通入足量的氯气,充分反应后将溶液蒸干,并灼烧残留物,最后得到的物质是(提示:溴单质易挥发、碘单质易华)( )
| A、NaCl、I2 |
| B、NaCl、NaBr |
| C、NaBr、I2 |
| D、NaCl |


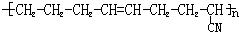 合成该高聚物的单体是
合成该高聚物的单体是