题目内容
已知氧化性Cl2>Br2>I2,向NaI和NaBr的混合溶液中通入足量的氯气,充分反应后将溶液蒸干,并灼烧残留物,最后得到的物质是(提示:溴单质易挥发、碘单质易华)( )
| A、NaCl、I2 |
| B、NaCl、NaBr |
| C、NaBr、I2 |
| D、NaCl |
考点:卤素原子结构及其性质的比较
专题:卤族元素
分析:因氧化性Cl2>Br2>I2,则在Br-、I-中,还原性由弱到强为Br-<I-,向含有NaBr和NaI的混合溶液中通入足量氯气发生:2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,结合Br2和I2的性质分析.
解答:
解:在Br-、I-中,还原性由弱到强为Br-<I-,向含有NaBr和NaI的混合溶液中通入足量氯气发生:2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,将溶液蒸干并充分灼烧,溴易挥发,碘易升华,得到固体剩余物质的组成只有氯化钠,
故选D.
故选D.
点评:本题考查卤素知识,为高频考点,注意把握物质的性质的异同,结合还原性强弱解答该题,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
镁、铝、铁、铜四种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
| A、Cu2+ |
| B、AlO2- |
| C、Al3+ |
| D、Mg2+ |
当有机物分子中的一个碳原子所连四个原子或原子团均不相同时,此碳原子就是“手性碳原子”,具有手性碳原子的物质往往具有旋光性,存在对映异构体,下列化合物中存在对映异构体的是( )
| A、C2H5CH═CHCH(CH3)-CH═CHC2H5 |
B、 |
| C、HCOOH |
| D、C6H5CH(CH3)CHO |
某固体混合物中含有Na2O2与NaHCO3,将其置于一密闭容器中,强热使之充分反应.下列有关说法正确的是( )
A、若剩余固体只为一种,则原混合物中
| ||
B、若剩余气体在标准状况下的相对分子质量为38,则原混合物中
| ||
C、若剩余气体只有一种,则原混合物中
| ||
D、若取16.2g剩余固体用盐酸溶解,当消耗0.3mol溶质时,恰好反应完且溶液呈中性,则原混合物中
|
金属氧化物在下列反应中不表现为碱性氧化物性质的是( )
A、Al2O3+Na2CO3
| ||||
B、FeO+SiO2
| ||||
| C、CaO+H2O═Ca(OH)2 | ||||
| D、CuO+2CH3COOH═Cu(CH3COO)2+H2O |
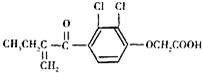 我国崇尚体育公平,倡导绿色奥运,而运动员服用兴奋剂事件有时有发生,图是兴奋剂利尿酸的结构.关于它的说法不正确的是( )
我国崇尚体育公平,倡导绿色奥运,而运动员服用兴奋剂事件有时有发生,图是兴奋剂利尿酸的结构.关于它的说法不正确的是( )| A、利尿酸的分子式为:C13H12O4Cl2 |
| B、1mol利尿酸最多可与5mol H2发生反应 |
| C、利尿酸所有碳原子可能共面 |
| D、利尿酸在一定条件下能发生消去、氧化、还原、水解、银镜等反应 |
下列物质所含分子数最少的是( )
| A、标准状况下11.2L HCl |
| B、6.02×1023个N2 |
| C、1.5mol H2O |
| D、32g O2(O2的摩尔质量32g/mol) |
下列反应中,能证明SiO2是酸性氧化物的是( )
| A、SiO2+2C═Si+2CO↑ |
| B、SiO2+2NaOH═Na2SiO3+H2O |
| C、SiO2+4HF═SiF4↑+2H2O |
| D、SiO2+CaCO3═CaSiO3+CO2↑ |
