题目内容
(每空2分,共6分)在下图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液。请回答下列问题:
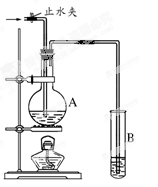
(1)若向A中通入足量的二氧化硫气体,A中的现象是 。
(2)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和 性。
(3)如果A中盛的是浓盐酸,加入二氧化锰,加热反应,此反应中浓盐酸的作用是 。

(1)若向A中通入足量的二氧化硫气体,A中的现象是 。
(2)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和 性。
(3)如果A中盛的是浓盐酸,加入二氧化锰,加热反应,此反应中浓盐酸的作用是 。
37.(每空2分,共6分)(1) 红色褪去 。(2) 强氧化 。(3) 还原剂 。
(1)SO2具有漂白性,能使品红溶液褪色。
(2)浓硫酸再加热的条件下,和铜发生氧化还原反应,生成硫酸铜、SO2和水,所以表现硫酸的氧化性和酸性。
(3)在加热的条件下,二氧化锰能氧化浓盐酸,生成氯化锰、氯气和水,所以表现盐酸的还原性和酸性。
(2)浓硫酸再加热的条件下,和铜发生氧化还原反应,生成硫酸铜、SO2和水,所以表现硫酸的氧化性和酸性。
(3)在加热的条件下,二氧化锰能氧化浓盐酸,生成氯化锰、氯气和水,所以表现盐酸的还原性和酸性。

练习册系列答案
相关题目

 和
和 的反应,用类比的方法推理
的反应,用类比的方法推理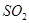 反应的固体产物为__________。另一部分同学依据
反应的固体产物为__________。另一部分同学依据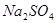 。为检验生成物中是否存在
。为检验生成物中是否存在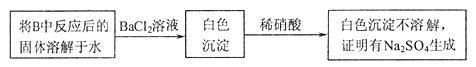
 溶液中缓慢通入
溶液中缓慢通入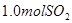 气体,请分析通入
气体,请分析通入 的范围
的范围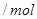
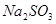 、
、