题目内容
Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是:
| A.[Na+]>[S2-]>[OH-]>[HS-]>[H+] |
| B.[Na+]+[H+]==[S2-]+[HS-]+[OH-] |
| C.[Na+]==[HS-]+2[H2S]+2[S2-] |
| D.[OH-]==[H+]+[HS-]+[H2S] |
A
【错解分析】电解质的水溶液中一定存在两个守恒:①物质守恒,②电荷守恒。通俗的说:①各种元素的微粒既不可增加也不可减少;②电解质溶液中存在各种带电的微粒,但所带电量的代数和等于零,即溶液不带电。结合本题有如下两个等式:(在同一体积中,用浓度表示即可)
物质守恒:
[Na+]==2[HS-]+2[H2S]+2[S2-] ①
电荷守恒:[Na+]+[H+]==2[S2-]+[HS-]+[OH-] ②
在物质守恒中,应该找出该元素可能转化生成的各种微粒。如本题的硫元素,它来源于Na2S中的S2-,少量的S2-要水解转化成HS-,微量的HS-进一步水解转化成H2S,虽然生成H2S的量很小,很小,但在理论上不能没有。另外,含硫元素的各种微粒与钠离子的物质的量之比应符合原化学式中各微粒的比值。选项C违背了上述要求。
在电荷守恒中,如何计算带多个单位电荷的微粒所带电量,往往容易出现误解。从表面形式上看,该微粒已带多个单位电荷,若用其所带电荷数乘以其浓度,似乎远远大于实际所带电量。实际上浓度只表示该微粒在单位体积里其物质的量(微粒)的多少,并不表示它带电量的多少。用其所带电荷数乘以其浓度,恰好计算其所带电量。选项B即错在此处。
由上述两个等式,通过代入变换,还可得到多个其他形式的等式。如②-①的整理得:[OH-]==[H+]+[HS-]+2[H2S],可判断选项D是错误答案。
【正解】选项A,可以半定量地分析得出结论。假设Na2S的浓度为0.1mol·L-1,则[Na+]为0.2mol·L-1;硫离子少部分发生水解,其平衡浓度比0.1mol·L-1小,而水解生成硫氢根离子和氢氧根离子的浓度远远小于0.1mol·L-1(仍大于0.001mol·L-1);由于硫氢根离子受到一定浓度的氢氧根离子影响(抑制其水解),其还要发生微弱的水解(存在电离和水解两种趋势,但水解趋势大于电离趋势),这样氢氧根离子的浓度将大于硫氢根离子的浓度;溶液呈碱性,其[H+]将由水的离子积和[OH-]求出,很明显其浓度远远小于[HS-](其与[OH-]在同一数量级上)。

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
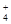 )与c(SO
)与c(SO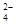 )之比是 ( )
)之比是 ( )