题目内容
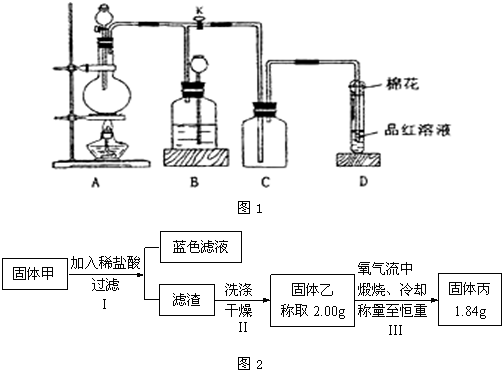
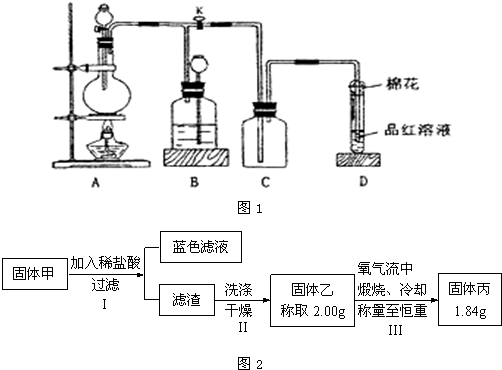
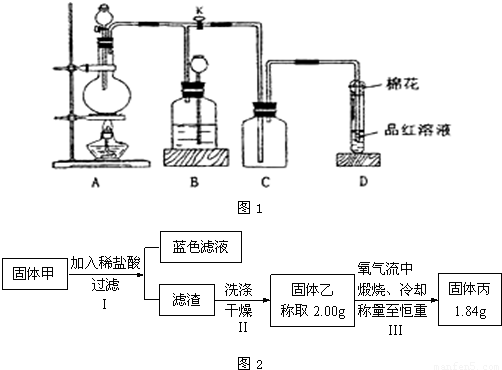
用如图1所示装置进行相关实验(夹持仪器省略),回答下列问题:
(1)图1中D装置在实验中的作用是____________,实验前检查该装置气密性的方法是_____________________________________________________________________。
(2)如图1,将液体A逐滴加入到固体B中即产生气体,该气体可以是(填化学式,不少于3种)____________________________________________________________________。
(3)如图1,若A为浓盐酸,B为MnO2,C容器中盛KI淀粉溶液,旋开E后,给烧瓶加热,一段时间后C中的现象是_________________________________________,写出烧瓶中发生反应的化学方程式__________________________________________________________。
(4)如图1,溶液A中可能含有Mg2+、Cu2+、Al3+、Fe3+四种阳离子,B为淡黄色固体,旋开E后,有气体放出和白色沉淀产生,淡黄色固体的物质的量与产生沉淀的质量关系如图2所示,则溶液中含有的阳离子有___________________,写出图2曲线中A—B段反应的离子方程式____________________________;求A溶液中存在的阳离子的物质的量浓度之比,并写出计算过程。
(1)防止溶液倒吸 关闭E,用手捂热(或微热)烧瓶,若导管口有气泡放出,松开手后,导管内有一段水柱回升,则说明装置气密性良好
(2)CO2、H2、O2、NO2、H2S、SO2、C2H2中的任意三种即可
(3)溶液变蓝色(答溶液变蓝色后又褪色也可)
MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)Mg2+、Al3+,Al(OH)3+OH-====![]() +2H2O
+2H2O
或2Na2O2+2H2O====4Na++4OH-+O2↑,
Al(OH)3+OH-====![]() +2H2O
+2H2O
解:由图可知A~B段溶解Al(OH)3消耗的Na2O2为1 mol,则NaOH为2 mol,根据反应方程式Al(OH)3+NaOH====NaAlO2+2H2O知Al(OH)3的物质的量为2 mol,Al3+也为2 mol
O~A段生成沉淀所消耗Na2O2为4 mol,需NaOH为8 mol,而2 mol Al3+生成Al(OH)3沉淀消耗NaOH 6 mol,则Mg2+消耗NaOH 2 mol,Mg2+的物质的量为1 mol。
故Mg2+与Al3+的物质的量之比为1∶2,
即Mg2+与Al3+的物质的量浓度之比为1∶2。