题目内容
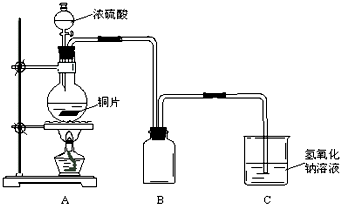
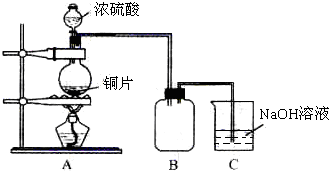
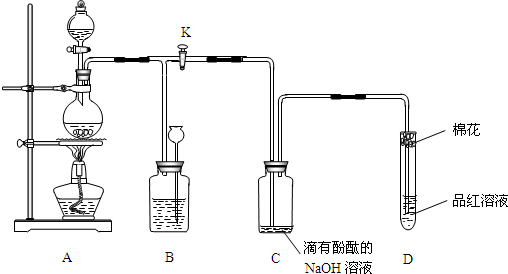
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图1所示装置进行有关实验.
已知:①SO2难溶于饱和亚硫酸氢钠溶液.②SO2能与酸性高锰酸钾溶液发生氧化还原反应.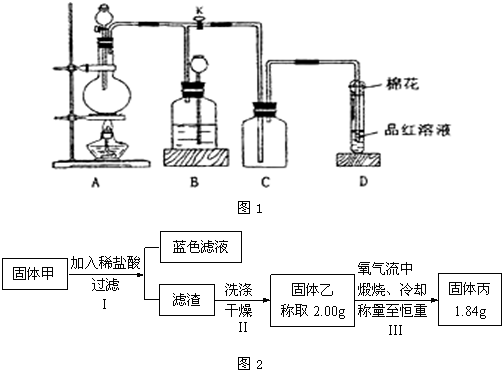
请回答:
(1)装置A中发生的化学反应方程式为
a.酸性 b.脱水性 c.强氧化性 d.吸水性
(2)装置D中试管口放置的棉花中浸入
(3)装置B的作用是贮存多余的气体.当D处有明显的现象后,关闭旋塞K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中的现象是
a.水 b.饱和NaHSO3溶液 c.酸性KMnO4溶液 d.NaOH溶液
(4)实验中,取一定质量的铜片和一定体积18.4mol?L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①有一定量的余酸但未能使铜片完全溶解,你认为原因是
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是(填字母)
a.银粉 b.铁粉 c.BaCl2溶液 d.NaHCO3溶液
(5)实验中发现试管内除了产生白色固体外,在铜表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料:
i.氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
ii.硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图2所示实验:
①Ⅲ中在煅烧过程中一定发生的反应的化学方程式为
②下列对于固体甲的成分的判断中,正确的是(填字母选项)
a.固体甲中,CuO和Cu2O至少有一种
b.固体甲中,CuS和Cu2S不能同时存在
c.固体甲中若没有Cu2O,则一定有Cu2S
d.固体甲中若存在Cu2O,也可能有Cu2S.
已知:①SO2难溶于饱和亚硫酸氢钠溶液.②SO2能与酸性高锰酸钾溶液发生氧化还原反应.

请回答:
(1)装置A中发生的化学反应方程式为
Cu+2 H2SO4(浓)
CuSO4+SO2↑+2 H2O
| ||
Cu+2 H2SO4(浓)
CuSO4+SO2↑+2 H2O
.此反应表明浓硫酸具有(填字母)
| ||
ac
ac
.a.酸性 b.脱水性 c.强氧化性 d.吸水性
(2)装置D中试管口放置的棉花中浸入
NaOH
NaOH
溶液,其作用是吸收SO2气体,防止污染空气
吸收SO2气体,防止污染空气
.(3)装置B的作用是贮存多余的气体.当D处有明显的现象后,关闭旋塞K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中的现象是
集气瓶内液面下降,长颈漏斗内液面上升
集气瓶内液面下降,长颈漏斗内液面上升
.B中应放置的液体是(填字母)b
b
.a.水 b.饱和NaHSO3溶液 c.酸性KMnO4溶液 d.NaOH溶液
(4)实验中,取一定质量的铜片和一定体积18.4mol?L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①有一定量的余酸但未能使铜片完全溶解,你认为原因是
浓硫酸由浓变稀,稀硫酸不再与铜反应
浓硫酸由浓变稀,稀硫酸不再与铜反应
.②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是(填字母)
b、d
b、d
.a.银粉 b.铁粉 c.BaCl2溶液 d.NaHCO3溶液
(5)实验中发现试管内除了产生白色固体外,在铜表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料:
i.氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
ii.硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图2所示实验:
①Ⅲ中在煅烧过程中一定发生的反应的化学方程式为
2CuS+3O2
2CuO+2SO2
| ||
2CuS+3O2
2CuO+2SO2
.
| ||
②下列对于固体甲的成分的判断中,正确的是(填字母选项)
a c d
a c d
.a.固体甲中,CuO和Cu2O至少有一种
b.固体甲中,CuS和Cu2S不能同时存在
c.固体甲中若没有Cu2O,则一定有Cu2S
d.固体甲中若存在Cu2O,也可能有Cu2S.
分析:(1)浓硫酸和铜在加热条件下发生反应生成硫酸铜、水和二氧化硫;反应中浓硫酸起到酸性和氧化性的作用;
(2)二氧化硫污染空气,应用氢氧化钠溶液吸收;
(3)装置B的作用是贮存多余的气体,所盛装溶液应避免二氧化硫的溶解和发生化学反应;
(4)稀硫酸氧化性较弱,与铜不反应;
(5)固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种.
分析反应:Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,
故③中在煅烧过程中一定发生的反应的化学方程式为2CuS+3O2
2CuO+2SO2 (条件也可为“煅烧”).
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.84g”,即实际减重了,说明必有CuS,还要有其他物质.讨论可能存在的情况可解答该题.
(2)二氧化硫污染空气,应用氢氧化钠溶液吸收;
(3)装置B的作用是贮存多余的气体,所盛装溶液应避免二氧化硫的溶解和发生化学反应;
(4)稀硫酸氧化性较弱,与铜不反应;
(5)固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种.
分析反应:Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,
故③中在煅烧过程中一定发生的反应的化学方程式为2CuS+3O2
| ||
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.84g”,即实际减重了,说明必有CuS,还要有其他物质.讨论可能存在的情况可解答该题.
解答:解:(1)浓硫酸和铜在加热条件下发生反应生成硫酸铜、水和二氧化硫,反应的方程式为Cu+2 H2SO4(浓)
CuSO4+SO2↑+2 H2O;反应中浓硫酸起到酸性和氧化性的作用,
故答案为:Cu+2 H2SO4(浓)
CuSO4+SO2↑+2 H2O;a c;
(2)二氧化硫污染空气,应用氢氧化钠溶液吸收,可在棉花上浸有NaOH溶液,故答案为:NaOH;吸收SO2气体,防止污染空气;
(3)二氧化硫易溶于水,可观察到集气瓶内液面下降,长颈漏斗内液面上升,装置B的作用是贮存多余的气体,所盛装溶液应避免二氧化硫的溶解和发生化学反应,则应选择饱和NaHSO3溶液,
故答案为:集气瓶内液面下降,长颈漏斗内液面上升;b;
(4)①一定质量的铜片和12ml 18mol?L-1浓硫酸放在圆底烧瓶中共热,最后发现烧瓶中还有铜片剩余,说明一定剩余酸,这是因为浓硫酸随着反应进行,浓度变小成为稀硫酸,不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解;
故答案为:浓硫酸由浓变稀,稀硫酸不再与铜反应;
②验证剩余的稀硫酸,必须与硫酸反应且现象明显,所以加入铁粉会生成气体说明含有氢离子证明有余酸,加入氯化钡溶液会产生白色沉淀式硫酸根离子的性质,因反应生成的产物中含有硫酸铜,也可以生成白色沉淀,所以不能证明酸的存在,加入银粉不反应不能证明,加入碳酸氢钠溶液生成气体说明有气体生成是氢离子的性质可以证明有酸的存在,
故答案为:b、d;
(5)①根据反应判断:Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,则一定存在2CuS+3O2
2CuO+2SO2,
故答案为:2CuS+3O2
2CuO+2SO2;
②经分析固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种.
分析反应:Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.84g”,即实际减重了,说明必有CuS,还要有其他物质.
讨论:①若有Cu2O,Cu2S可有可无;
②若无Cu2O,必有Cu2S.
经上分析,对于固体甲的成分的判断中,正确的是acd,
故答案为:a c d.
| ||
故答案为:Cu+2 H2SO4(浓)
| ||
(2)二氧化硫污染空气,应用氢氧化钠溶液吸收,可在棉花上浸有NaOH溶液,故答案为:NaOH;吸收SO2气体,防止污染空气;
(3)二氧化硫易溶于水,可观察到集气瓶内液面下降,长颈漏斗内液面上升,装置B的作用是贮存多余的气体,所盛装溶液应避免二氧化硫的溶解和发生化学反应,则应选择饱和NaHSO3溶液,
故答案为:集气瓶内液面下降,长颈漏斗内液面上升;b;
(4)①一定质量的铜片和12ml 18mol?L-1浓硫酸放在圆底烧瓶中共热,最后发现烧瓶中还有铜片剩余,说明一定剩余酸,这是因为浓硫酸随着反应进行,浓度变小成为稀硫酸,不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解;
故答案为:浓硫酸由浓变稀,稀硫酸不再与铜反应;
②验证剩余的稀硫酸,必须与硫酸反应且现象明显,所以加入铁粉会生成气体说明含有氢离子证明有余酸,加入氯化钡溶液会产生白色沉淀式硫酸根离子的性质,因反应生成的产物中含有硫酸铜,也可以生成白色沉淀,所以不能证明酸的存在,加入银粉不反应不能证明,加入碳酸氢钠溶液生成气体说明有气体生成是氢离子的性质可以证明有酸的存在,
故答案为:b、d;
(5)①根据反应判断:Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,则一定存在2CuS+3O2
| ||
故答案为:2CuS+3O2
| ||
②经分析固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种.
分析反应:Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.84g”,即实际减重了,说明必有CuS,还要有其他物质.
讨论:①若有Cu2O,Cu2S可有可无;
②若无Cu2O,必有Cu2S.
经上分析,对于固体甲的成分的判断中,正确的是acd,
故答案为:a c d.
点评:本题整合和拓展了教材中的典型实验,侧重基本实验操作能力考查,一定要弄清楚课本中的基本实验,要通过动手做实验去了解仪器的结构、适用范围和工作原理,掌握常见气体的制备、除杂、收集、尾气处理等基本操作,熟悉教材中的典型实验装置.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
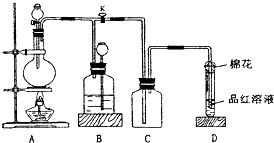 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答:
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答: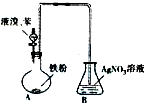 某化学课外兴趣小组为探究苯与溴发生反应的反应类型并制取纯净的溴苯,进行如下实验.请根据要求回答相关问题.
某化学课外兴趣小组为探究苯与溴发生反应的反应类型并制取纯净的溴苯,进行如下实验.请根据要求回答相关问题.