题目内容
【题目】某温度下,向10 mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,溶液中-lgc(Cu2+)与滴加的Na2S溶液体积(V)的关系如图所示(忽略体积变化)。下列判断正确的是
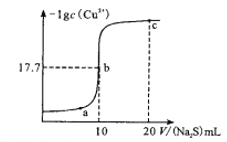
A. a、b、c三点中,b点水的电离程度最大
B. a点:2c(Cu2+)+c(H+)=c(Cl-)+c(OH-)
C. c点溶液:c(Cu2+)=3×10-34.4mol/L
D. c点溶液有:n(S2-)+n(HS-)+n(H2S)=n(Cl-)
【答案】C
【解析】A、Cu2+或S2-均会水解,水解促进水的电离,b点溶液时滴加Na2S溶液的体积是10mL,此时恰好生成CuS沉淀,b点溶液中水的电离程度最小,A错误;B、根据电荷守恒可知a点溶液中2c(Cu2+)+c(H+)=2(S2-)+c(Cl-)+c(OH-),B错误;C、b点时滴加Na2S溶液的体积是10mL,此时恰好生成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s)Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,因此硫化铜的溶度积常数是10-35.4。c点加入20mL硫化钠溶液,硫化钠过量,溶液中硫离子浓度是![]() ,所以根据溶度积常数可知c点溶液中c(Cu2+)=
,所以根据溶度积常数可知c点溶液中c(Cu2+)=  =3×10-34.4mol/L,C正确;D、c点加入20mL硫化钠溶液,由于有CuS沉淀生成,所以根据氯离子和硫原子守恒可知溶液中n(S2-)+n(HS-)+n(H2S)<n(Cl-),D错误;答案选C。
=3×10-34.4mol/L,C正确;D、c点加入20mL硫化钠溶液,由于有CuS沉淀生成,所以根据氯离子和硫原子守恒可知溶液中n(S2-)+n(HS-)+n(H2S)<n(Cl-),D错误;答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】在三个容积均为1L的恒温恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应3CO(g)+3H2(g)![]() (CH3)2O(g)+CO2(g)(不发生其他反应),CO的平衡转化率与温度和压强的关系加下图所示。
(CH3)2O(g)+CO2(g)(不发生其他反应),CO的平衡转化率与温度和压强的关系加下图所示。
容器 | 起始物质的量/mol | 平衡 转化率 | |||
CO | H2 | (CH3)2O | CO2 | CO | |
Ⅰ | 0.3 | 0.3 | 0 | 0 | 50% |
Ⅱ | 0.3 | 0.3 | 0 | 0.1 | |
Ⅲ | 0 | 0 | 0.2 | 0.4 | |
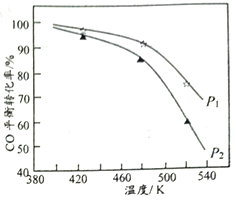
下列说法正确的是( )
A. 该反应的△H<0,图中压强p1>p2
B. 达到平衡时,容器Ⅱ中CO的平衡转化率大于50%
C. 达到平衡时,容器Ⅰ与容器Ⅱ的总压强之比小于4∶5
D. 达到平衡时,容器Ⅲ中n[(CH3)2O]是容器Ⅱ中的2倍