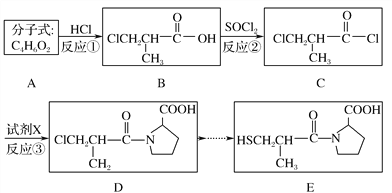
��Ŀ����
����Ŀ����.��ҵ����ij����������Cu2O��A12O3��Fe2O3��SiO2)��ȡͭ�Ĺ���������ͼ��

��֪��Cu2O+2H+=Cu+Cu2++H2O��
(1)��Ҫ���������������Ľ����ʣ����Բ��õĴ�ʩ��____________ (��дһ������
�ڿ��������չ�������Dʱ���õ����ֹ������ʵ������������������ƾ��ƣ�����Ҫ�õ���������_____________��
(2)��ҺA����Ԫ�صĴ�����ʽһ����________(�����ӷ��ţ������ɸ����ӵ����ӷ���ʽΪ__________��
(3)�����£���pH��NaA1O2��NaOH������Һ�У���ˮ�������c(OH-)ǰ��Ϊ���ߵ�106������������Һ��pH =________��
��.����Cu2O�������Ĵ����Ͱ뵼����ϣ���ҵ�ϳ������з����Ʊ�Cu2O��
���Ȼ�ԭ�������������£���Һ̬�£�N2H4)��ԭ���Ƶ�Cu(OH)2�Ʊ�Cu2O��ͬʱ�ų�N2��
�ڵ�ⷨ���Լ״�ȼ�ϵ��Ϊ��Դ���õ�ⷨ�Ʊ�Cu2O��װ����ͼ��ʾ��

(4)д����Ӧ�ٵĻ�ѧ����ʽ��___________________��
(5)����A�Ļ�ѧʽΪ____________��
(6)�����У������ĵ缫��ӦʽΪ___________________��
(7)���һ��ʱ�����ʹ��������Һ�ָ�ԭ����ɣ�Ӧ�����в���һ������_____________(�ѧʽ����
���𰸡� �����¶Ȼ���������Ũ�Ȼ��������������𰸾����֣� ���� �� ������ Fe2+ Cu+2Fe3+=2Fe2++Cu2+ 10 4Cu(OH)2+N2H4![]() N2��+2Cu2O+6H2O O2
N2��+2Cu2O+6H2O O2 ![]() =Cu2O+H2O H2O
=Cu2O+H2O H2O
��������(1)��Ҫ���������������Ľ����ʣ�������������Է�Ӧ���ʵ�Ӱ���֪���Բ��õĴ�ʩ�������¶Ȼ���������Ũ�Ȼ����������ڿ��������չ�������Dʱ���õ����ֹ������ʵ������������������ƾ��ƣ�����Ҫ�õ��������������������ǡ�(2)������������������ת��Ϊ�Ȼ�����������ͭת��Ϊ�Ȼ�ͭ��ͭ����������������������ͭ������ҺA����Ԫ�صĴ�����ʽһ����Fe2+�����ɸ����ӵ����ӷ���ʽΪCu+2Fe3+=2Fe2++Cu2+��(3)ƫ������ˮ��ٽ�ˮ�ĵ��룬����������ǿ������ˮ�ĵ��룬��![]() �����x��10��(4)���������£���Һ̬�£�N2H4)��ԭ���Ƶ�Cu(OH)2�Ʊ�Cu2O��ͬʱ�ų�N2������ԭ���غ�͵��ӵ�ʧ�غ��֪��Ӧ�Ļ�ѧ����ʽΪ4Cu(OH)2+N2H4
�����x��10��(4)���������£���Һ̬�£�N2H4)��ԭ���Ƶ�Cu(OH)2�Ʊ�Cu2O��ͬʱ�ų�N2������ԭ���غ�͵��ӵ�ʧ�غ��֪��Ӧ�Ļ�ѧ����ʽΪ4Cu(OH)2+N2H4![]() N2��+2Cu2O+6H2O��(5)������ͭ�缫��������ʧȥ����ת��Ϊ������ͭ������ͭ�缫�����ĵ缫����������������A�Ļ�ѧʽΪO2��(6)�������Ϸ�����֪�����У������ĵ缫��ӦʽΪ2Cu+2OH�D�D2e����Cu2O+H2O��(7)���ص����������ӷŵ�����������ƣ���������Ũ����������һ��ʱ�����ʹ��������Һ�ָ�ԭ����ɣ�Ӧ�����в���һ������H2O��
N2��+2Cu2O+6H2O��(5)������ͭ�缫��������ʧȥ����ת��Ϊ������ͭ������ͭ�缫�����ĵ缫����������������A�Ļ�ѧʽΪO2��(6)�������Ϸ�����֪�����У������ĵ缫��ӦʽΪ2Cu+2OH�D�D2e����Cu2O+H2O��(7)���ص����������ӷŵ�����������ƣ���������Ũ����������һ��ʱ�����ʹ��������Һ�ָ�ԭ����ɣ�Ӧ�����в���һ������H2O��

 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�����Ŀ����������Ԫ�أ�����A��B��C��DΪ����������Ԫ�أ�E��FΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش����⣮
Aԭ�Ӻ�����ӷ�ռ3����ͬ�ܼ�����ÿ���ܼ����Ų��ĵ�������ͬ |
BԪ��ԭ�ӵĺ���p����������s����������1 |
Cԭ��p����ϳɶԵ���������δ�ɶԵ�����������Aͬ���� |
DԪ�ص������������������IJ�Ϊ4���Ҳ���AԪ����ͬһ���� |
E�ǵ�����Ԫ�� |
F�ǵ�29��Ԫ�� |
��1��A�Ļ�̬ԭ����������ߵĵ��ӣ���������ڿռ��� ������ԭ�ӹ���� �Ρ�
��2��E2+�Ļ�̬��������Ų�ʽΪ ��
��3��A��B��C����Ԫ�ص�����⻯����۵��ɵ͵��ߵ�˳���� ����B��C����Ԫ����ɵķ�����AC2��Ϊ�ȵ�����ķ��ӵĽṹʽΪ ��(�û�ѧʽ��ʾ)
��4��BD3 ����ԭ�ӵ��ӻ���ʽΪ ������ӿռ乹��Ϊ ��
��5���þ����x�������䷨��F�IJⶨ�õ����½����F�ľ���Ϊ�����������ܶѻ�(��ͼ)����֪�þ�����ܶ�Ϊ9.00g/cm3�������и�ԭ�ӵ���λ��Ϊ ��F��ԭ�Ӱ뾶�� cm��(�����ӵ�����ΪNA��Ҫ����ʽ����)��