题目内容
【题目】某盐酸的密度为![]() ,HCl的质量分数为
,HCl的质量分数为![]() ,试计算:
,试计算:
(1)该盐酸的物质的量浓度是多少?(小数点后保留两位)_________
(2)在足量的该盐酸溶液中,加入镁粉和铝粉混合物![]() ,充分反应共生成
,充分反应共生成![]() 气体(标准状况),求混合物中镁和铝的质量各为多少?____________,_______________
气体(标准状况),求混合物中镁和铝的质量各为多少?____________,_______________
【答案】![]() 3.6g 18.9g
3.6g 18.9g
【解析】
(1)![]()
![]() ;
;
(2)设镁的物质的量是xmol、铝的物质的量是ymol,根据Mg+H2SO4= MgSO4+H2↑,镁生成的氢气物质的量是xmol,根据2Al+3H2SO4= Al2(SO4)3+3H2↑,铝生成的氢气的物质的量是![]() mol;
mol;
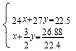 ,解得
,解得![]() ,镁的质量是0.15mol×24g/mol=3.6g,铝的质量是0.7mol×27g/mol=18.9g。
,镁的质量是0.15mol×24g/mol=3.6g,铝的质量是0.7mol×27g/mol=18.9g。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目