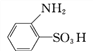
��Ŀ����
����Ŀ��ij����С��������Ȳ������KMnO4��Һ��Ӧ���ⶨ��Ȳ����Է�����������ͼ�Dzⶨװ��ʾ��ͼ����С��ʵ�����£�ʵ��ǰ��Dװ����KMnO4�����ʵ���Ϊxmol��ʵ����ϣ�D��Eװ�õ�������������yg����ʱD�й�����KMnO4ǡ�����뺬zmol FeSO4����Һ��ȫ��Ӧ(ע����Ӧ��MnO4������ԭ��Mn2����Fe2����������Fe3��)��ͨ�����㼴�ɲ����Ȳ����Է���������

��1��ʵ������ȡ��Ȳʱ����Һ©���е�Һ��aͨ����_________________��
��2��CuSO4��Һ��������_____________________��
��3����ƽ��Ȳ������KMnO4��Һ��Ӧ�Ļ�ѧ����ʽ�����ڷ����������ϵ������
��C2H2����KMnO4����H2SO4����K2SO4����MnSO4����CO2������H2O_______________
��4������С��ʵ��ԭ�������в�������ȷ�������и����ض�������Ȳ����Է�������û��Ӱ����ǣ���ѡ�____________��
A��װ��A�в���������ֱ��ͨ������KMnO4��Һ
B����Ȳͨ������KMnO4��Һ�����ʹ��죬������Ȳδ���������ݳ�
C����Eװ�ã�ʢ�м�ʯ�ҵĸ���ܣ�����ʢ��Ũ�����ϴ��ƿ
��5����һ����С����Ϊ���ÿ���С���ʵ��װ�ü�ʵ��������ڲ��㣬���ü�������˵����Ӧ��ȡ���ִ�ʩ��Ľ�����___________________________________________________________________��
���𰸡� ����ʳ��ˮ ��ȥ��Ȳ�����л��е�H2S��AsH3������ 1��2��3��1��2��2��4 B a����Eװ�ú����ٽ�һ��ʢ�м�ʯ�ҵĸ���ܣ�b�������ϵĸĽ�����D��ͨ���������Ȳ��ֱ������KMnO4��Һ��ȫ��ɫ���ٲ���D��Eװ�������������ӡ�
��������(1)���ڵ�ʯ��ˮ��Ӧ������Ȳ�ܾ��ң�Ϊ�˵õ�ƽ�ȵ���Ȳ���������ñ���ʳ��ˮ����ˮ����ʵ�飬���Է�Һ©���е�Һ��aͨ���DZ���ʳ��ˮ��
(2)���ڵ�ʯ�к�������CaS��Ca3As2�ȣ�Ҳ����ˮ��Ӧ�����ж���H2S��AsH3��������CuSO4��Һ��ȥ��
(3)C2H2��CԪ����-1�����ߵ�+4�ۣ���KMnO4�е�MnԪ����+7�۽��͵�+2�ۣ����ݵ���ת���غ����ƽ����ʽΪC2H2��2KMnO4��3H2SO4��K2SO4��2MnSO4��2CO2����4H2O��
(4)A��װ��A�в���������ֱ��ͨ������KMnO4��Һ������Ȳ�����е�����Ҳ������KMnO4��Һ�������գ����²���������������Ӱ��ⶨ�������A����B����Ȳͨ������KMnO4��Һ�����ʹ��죬������Ȳδ���������ݳ�����Ӱ��������KMnO4��Һ��Ӧ����Ȳ�����IJⶨ����B��ȷ��C����Eװ�ã�ʢ�м�ʯ�ҵĸ���ܣ�����ʢ��Ũ�����ϴ��ƿ��������Ȳ������KMnO4��Һ��Ӧ��������CO2���ܱ����գ�Ӱ����Ȳ�����IJⶨ����C���������ȷ��ΪB��
(5) a��Eװ���ܹ����տ����е�ˮ������CO2���壬���²������������������Կ���Eװ�ú����ٽ�һ��ʢ�м�ʯ�ҵĸ���ܣ�b�������ϵĸĽ�����D��ͨ���������Ȳ��ֱ������KMnO4��Һ��ȫ��ɫ���ٲ���D��Eװ�������������ӡ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�