题目内容
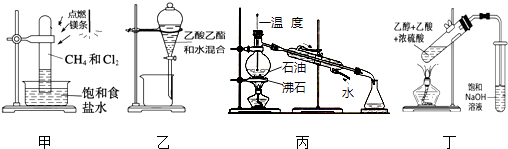
【题目】实验室可以用下图所示的装置制取乙酸乙酯。回答下列问题:

(1)制得的乙酸乙酯在饱和碳酸钠溶液的_______层。(填“上”或“下”)
(2)浓硫酸的作用是______________。
(3)制取乙酸乙酯的化学方程式是___________,该反应属于______(填反应类型)反应。
(4)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_________。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol 乙醇。
【答案】 上 催化剂、吸水剂 CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ H2O 取代反应 ①③
CH3COOCH2CH3+ H2O 取代反应 ①③
【解析】(1)乙酸乙酯的密度小于水,不溶于饱和碳酸钠溶液,在液面的上层。
(2)浓硫酸的作用是催化剂、吸水剂。
(3)乙酸和乙醇在浓硫酸作用下发生取代反应生成乙酸乙酯。
(4)满足V(正)=V(逆),各组分的浓度保持不变,反应达到平衡状态,据此进行分析。
(1)乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,在碳酸钠溶液的上层;正确答案:上。
(2)再合成乙酸乙酯的反应中,浓硫酸起到了催化、吸水的作用,加快反应速率,有利于反应向右进行;正确答案:催化剂、吸水剂。
(3)制取乙酸乙酯的化学方程式是. CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ H2O;该反应属于取代反应;正确答案:CH3COOH + CH3CH2OH
CH3COOCH2CH3+ H2O;该反应属于取代反应;正确答案:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ H2O ;取代反应。
CH3COOCH2CH3+ H2O ;取代反应。
(4)①混合物中各物质的浓度不再变化,各物质的量不再发生变化,反应已达到化学平衡状态,正确;②化学反应速率之比等于化学计量数之比,单位时间里,生成1mol乙醇(反应向左),同时生成1mol乙酸(反应向左),反应速率同向,不能说明乙醇与乙酸的酯化反应已达到化学平衡状态,错误;③单位时间里,生成1mol乙酸乙酯(反应向右),同时生成1mol乙醇(反应向左),满足正逆反应速率相等,说明乙醇与乙酸的酯化反应已达到化学平衡状态,正确;正确选项①③。