题目内容
X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+3。回答下列问题:
(1)Y-的结构示意图为 。
(2)写出含有10个中子的X原子的原子符号 。
(3)Z的最高价氧化物与Z同主族的单质A能发生置换反应,这个反应在工业上是获得Z的一步重要反应。写出该步反应的化学方程式,并用单线桥法标出电子转移的方向与数目 。
(4)向WY3溶液中加入足量的NaOH溶液,反应的离子方程式为 。
(5)Y的气态氢化物与氨气在空气中相遇有白烟生成,该反应的化学方程式为 。
(6)ZX2中存在的化学键为 (填“离子键”或“共价键”),ZX2与NaOH溶液反应的化学方程式为 。
(1)  (2)188O
(2)188O
(3)
(4)Al3++4OH-=AlO2-+2H2O
(5)HCl+NH3=NH4Cl
(6)共价键 SiO2+2NaOH=Na2SiO3+H2O
【解析】X原子的最外层电子数是核外电子层数的3倍,X为O;Y的最高正价与最低负价的代数和为6,设Y的最外层电子数为a,最高正价为a,最低负价为a-8,a+a-8=6,a=7,Y为Cl(F无正价);Z在地壳中的含量仅次于O,Z为Si;W的常见化合价为+3,W与Si同周期,W为Al。
(1)Cl-的结构示意图为
(2)含有10个中子的O的质量数为18,原子符号为188O。
(3)SiO2与C反应制备Si,反应方程式及单线桥法分析转移电子数为: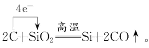
(4)AlCl3溶液中加入足量NaOH溶液,发生反应的离子方程式为Al3++4OH-=AlO2-+2H2O。
(5)HCl与NH3相遇生成NH4Cl固体,所以有白烟生成,反应的化学方程式为HCl+NH3=NH4Cl。
(6)SiO2中存在共价键,SiO2与NaOH溶液的反应为SiO2+2NaOH=Na2SiO3+H2O