题目内容
9.下列推断合理的是( )| A. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体可用作净水剂 | |
| B. | 将1molCu置于2molH2SO4的浓硫酸中加热,画有横线的物质,在反应中能被完全消耗 | |
| C. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| D. | 将SO2通入溴水,溴水褪色后加热能恢复原色 |
分析 根据胶体的性质来分析净化水的原因;铜只与浓硫酸反应与稀硫酸不反应;利用浓硫酸性质来分析与铜的反应;利用二氧化硫的漂白性和还原性来分析解答
解答 解:A、明矾[KAl(SO4)2•12H2O]在水中水解形成Al(OH)3胶体,胶体具有吸附性,则可用作净水剂,故A正确;
B、浓硫酸与铜反应,随着反应的进行变为稀硫酸,稀硫酸与铜不反应,故铜不能消耗完全,故B错误;
C、浓H2SO4虽然有强氧化性,在加热条件能与Cu发生反应,常温下不反应,故C错误;
D、SO2通入溴水后发生氧化还原反应,SO2+Br2+2H2O=H2SO4+2HBr,则将SO2通入溴水,溴水褪色后加热不能恢复原色,故D错误;
故选:A.
点评 本题虽然简单,但是从多方面考查了元素化合物及胶体性质,覆盖面广,是一好题.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
19.下列关于胶体的叙述不正确的是( )
| A. | 胶体区别于其他分散系的本质特征是分散质微粒直径在10-9~10-7m之间 | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体时,均能产生丁达尔现象 | |
| C. | 向豆浆中加入盐卤做豆腐是胶体聚沉在生活中的具体应用 | |
| D. | 溶液、胶体、浊液均属于混合物 |
20.下列物质中不能使高锰酸钾酸性溶液褪色的是( )
| A. | 丙烯 | B. | 苯 | C. | 甲苯 | D. | 乙炔 |
17.下列离子方程式正确的是( )
| A. | 大理石与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| C. | 将少量铜片放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 向澄清石灰水中加入过量的小苏打溶液:OH-+HCO3-+Ca2+═CaCO3↓+H2O |
4.下列关于物质用途的叙述中正确的是( )
| A. | Na2O可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | 纯碱可作治疗胃酸过多的一种药剂 | |
| D. | SO2可用于漂白一切有色物质 |
18.下列有机物属于芳香族化合物的是( )
| A. | 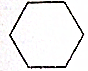 | B. |  | ||
| C. | 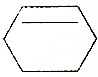 | D. |  |
8.下列措施能使铁与稀硫酸反应产生氢气的速率加快的是( )
| A. | 加入Na2SO4溶液 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |