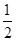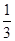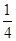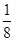题目内容
.根据下列反应判断有关物质还原性由强到弱的顺序是( )
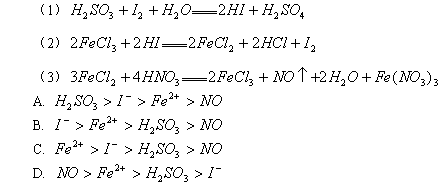
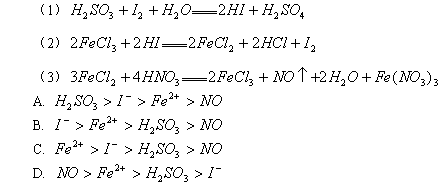
A
本题是根据物质氧化性或还原性强弱的规律解题。在同一氧化还原反应中,氧化剂+还原剂=还原产物+氧化产物,还原性:还原剂>还原产物;氧化性:氧化剂>氧化产物,概括为:左>右。据此规律,由反应式(1)可知还原性 ,由(2)可知还原性
,由(2)可知还原性 ,由(3)可知还原性
,由(3)可知还原性 。综合(1)(2)(3)得:
。综合(1)(2)(3)得: 。
。
 ,由(2)可知还原性
,由(2)可知还原性 ,由(3)可知还原性
,由(3)可知还原性 。综合(1)(2)(3)得:
。综合(1)(2)(3)得: 。
。
练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目