题目内容
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
(1)假设3:Br2能将Fe2+氧化为Fe3+而I2不能(2分)
(3)①2Fe2++Br2=2Fe3++2Br-(2分)
②取少量实验Ⅰ的黄色溶液于试管中,滴加几滴KSCN溶液,振荡,溶液变为红色。(3分)
③可能2:碘水与FeSO4溶液发生反应生成Fe2(SO4)3, Fe2(SO4)3溶液也是黄色的,所以溶液的颜色没有明显的变化。(2分,表述合理给分)丁(2分);理由:亚铁离子与空气接触容易被氧化,丁方案中加入乙酸乙酯既可作为萃取剂又能起到液封的作用,减少空气对实验的影响。(3分,表述合理给分)
(4)①酸式滴定管(1分)②0.0200×V×10-3×5 /(20×10-3)或0.0200×V×5 /20(2分)
(3)①2Fe2++Br2=2Fe3++2Br-(2分)
②取少量实验Ⅰ的黄色溶液于试管中,滴加几滴KSCN溶液,振荡,溶液变为红色。(3分)
③可能2:碘水与FeSO4溶液发生反应生成Fe2(SO4)3, Fe2(SO4)3溶液也是黄色的,所以溶液的颜色没有明显的变化。(2分,表述合理给分)丁(2分);理由:亚铁离子与空气接触容易被氧化,丁方案中加入乙酸乙酯既可作为萃取剂又能起到液封的作用,减少空气对实验的影响。(3分,表述合理给分)
(4)①酸式滴定管(1分)②0.0200×V×10-3×5 /(20×10-3)或0.0200×V×5 /20(2分)
试题分析:(1)根据前两个假设,结合溴与碘的氧化性 的强弱,提出第三个假设:Br2能将Fe2+氧化为Fe3+而I2不能;
(3)①溴氧化亚铁离子为铁离子,本身被还原成溴离子,离子方程式为2Fe2++Br2=2Fe3++2Br-
②需要补充的实验目的是验证铁离子的存在,所以取少量实验Ⅰ的黄色溶液于试管中,滴加几滴KSCN溶液,振荡,溶液变为红色,说明溴水能将Fe2+氧化;
③可能2是碘水与 FeSO4溶液反应生成硫酸铁,铁离子的颜色也为黄色;丁方案更合理,因为乙酸乙酯的密度比水小,且不溶于水,在溶液的上层,可以起到隔绝空气的作用,防止亚铁离子被空气中的氧气氧化;同时还起到萃取的作用,碘在有机溶剂中的溶解度大于在水中的溶解度,所以萃取后向下层液体中滴加KSCN溶液,判断有无铁离子生成;
(4)①酸性高锰酸钾溶液的氧化性强所以用酸式滴定管装酸性高锰酸钾溶液;②根据得失电子守恒,亚铁离子与高锰酸根离子之间的物质的量比例关系为5Fe2+~MnO4-,所以硫酸亚铁的浓度为0.0200×V×10-3×5 /(20×10-3)mol/L。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
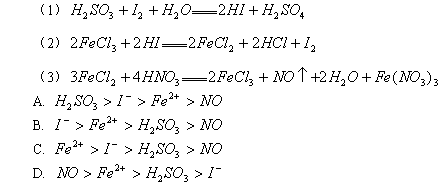
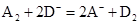 ,则氧化性:A2 > D2
,则氧化性:A2 > D2