题目内容
4.25℃时,水的电离达到平衡,下列叙述正确的是( )| A. | 向水中加人稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加人少量NH4Cl固体,c(OH-)增大 | |
| D. | 将水加热,Kw增大,pH不变 |
分析 A.氨水溶液显碱性,纯水显中性,碱中OH-浓度大于水中的OH-浓度;
B.硫酸氢钠能完全电离产生钠离子、氢离子和硫酸根离子;
C.铵根水解对水的电离起到促进作用;
D.温度升高,水的离子积常数增大,则pH值减小.
解答 解:A.向水中加入氨水,溶液由中性到碱性,碱对水的电离起抑制作用,所以平衡逆向移动,但c(OH-)增大,故A错误;
B.NaHSO4═Na++SO42-+H+,其中电离出的氢离子使c(H+)增大,但是温度不变,KW不变,故B正确;
C.NH4Cl中的铵根水解对水的电离起到促进作用,铵根离子结合水电离生成的氢氧根,电离平衡右移,c(OH-)降低,故C错误;
D.温度升高,水的离子积常数KW增大,则pH值减小,故D错误.
故选B.
点评 本题考查学生水的电离知识,难度不大,酸、碱对水的电离起抑制作用,水解的盐对水的电离起促进作用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列与实验相关的叙述正确的是( )
| A. | 配制浓硫酸、浓硝酸的混酸时,应将浓硝酸沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 用滴定管、量筒量取5.0mL液体,俯视读数时所得液体体积均大于5mL | |
| C. | 大试管、烧瓶、锥形瓶均可用于组装气体发生装置 | |
| D. | 实验室配制一定质量分数、一定物质的量浓度的溶液时均需使用容量瓶 |
12.已知aX n+和bYm- 两种离子的电子层结构相同,则下列关系成立的是( )
| A. | a=b+n-m | B. | 离子半径Y m-<X n+ | ||
| C. | 原子序数Y>X | D. | 原子半径X>Y |
9.已知:25°C时,Ksp〔Mg(OH)2〕=5.61×10-12,Ksp〔MgF2〕=7.42×10-11.下列说法正确的是( )
| A. | 25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25°C时,Mg(OH)2固体在20mL0.01 mol•L-1氨水中的Ksp比在20mL0.01mol•L-1NH4Cl溶液中的Ksp小 | |
| D. | 25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
16.向纯水中加入少量的NaHSO4晶体,维持温度不变,则该溶液( )
| A. | pH升高 | B. | pH降低 | ||
| C. | c(H+)、c(OH-)的乘积增大 | D. | pH维持不变 |
13.下列各有机物的分类或命名正确的是( )
| A. | 对甲基苯酚( )属于芳香烃 )属于芳香烃 | B. |  TNT TNT | ||
| C. |  2-乙基丁烷 2-乙基丁烷 | D. | 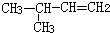 3-甲基-1-丁烯 3-甲基-1-丁烯 |
14.能在水溶液中大量共存的一组离子是( )
| A. | Fe3+、Mg2+、SCN-、Cl- | B. | Al3+、Mg2+、CO32-、Cl- | ||
| C. | K+、Ag+、Ca2+、NO3- | D. | Na+、H+、CH3COO-、Cl- |