题目内容
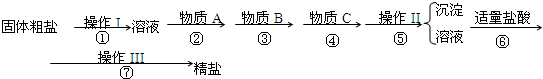
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)判断BaCl2已过量的方法是
(2)第④步中,有关的离子方程式是
(3)下列仪器,蒸发结晶时会用到的是
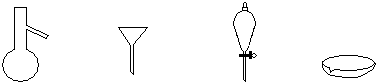
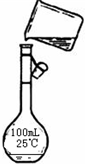
(4)为检验精盐纯度,需配制1000mL 0.2mol/L NaCl(精盐)溶液,回答下列问题:
①人们常将配制过程简述为以下各步骤:A.冷却;B.称量;C.洗涤;D.定容;E.溶解;F.摇匀;G.转移;H.装瓶.其正确的操作顺序应是
(A)B E F G C G D H A (B)B E G A C G F D H
(C)B E A G C G D F H (D)B E A G C G D H F
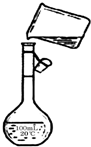
②若定容时观察液面仰视,会造成所配制的溶液浓度(填“偏高”或“偏低”)

(1)判断BaCl2已过量的方法是
取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量
取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量
(2)第④步中,有关的离子方程式是
Ca2++CO32-=CaCO3↓Ba2++CO32-=BaCO3↓
Ca2++CO32-=CaCO3↓Ba2++CO32-=BaCO3↓
.(3)下列仪器,蒸发结晶时会用到的是
蒸发皿
蒸发皿
(写仪器名称)
(4)为检验精盐纯度,需配制1000mL 0.2mol/L NaCl(精盐)溶液,回答下列问题:
①人们常将配制过程简述为以下各步骤:A.冷却;B.称量;C.洗涤;D.定容;E.溶解;F.摇匀;G.转移;H.装瓶.其正确的操作顺序应是
C
C
(填序号).(A)B E F G C G D H A (B)B E G A C G F D H
(C)B E A G C G D F H (D)B E A G C G D H F
②若定容时观察液面仰视,会造成所配制的溶液浓度(填“偏高”或“偏低”)
偏低
偏低
.分析:(1)氯化钡过量时,加入硫酸会产生白色沉淀;
(2)第④步中,加碳酸钠放在加氯化钡之后,可以将钙离子和过量的钡离子沉淀;
(3)根据粗盐提纯的步骤和所用的仪器进行解答;
(4)①根据实验操作的步骤进行排序;
②依据容量瓶是以刻度定液面的原理分析误差.
(2)第④步中,加碳酸钠放在加氯化钡之后,可以将钙离子和过量的钡离子沉淀;
(3)根据粗盐提纯的步骤和所用的仪器进行解答;
(4)①根据实验操作的步骤进行排序;
②依据容量瓶是以刻度定液面的原理分析误差.
解答:解:(1)氯化钡过量时,加入硫酸会产生白色沉淀,可以通过检验钡离子来确定氯化钡是否过量,取少量上层清液加入到试管中,向其中滴加稀硫酸,如果产生白色沉淀,证明氯化钡过量,
故答案为:取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量;
(2)除钙离子加入碳酸钠转化为沉淀,Ca2++CO32-=CaCO3↓,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,Ba2++CO32-=BaCO3↓,
故答案为:Ca2++CO32-=Ca CO3↓;Ba2++CO32-=Ba CO3↓;
(3)粗盐提纯的步骤是溶解、过滤、蒸发、结晶,由步骤可推测用的仪器是铁架台、漏斗、烧杯、玻璃棒、蒸发皿和酒精灯,
故答案为:蒸发皿;
(4)①根据实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签的实验操作步骤可知,正确的存在顺序为B E A G C G D F H,
故答案为:C;
②容量瓶配制溶液定容时,误差分析依据刻度丁液面分析判断,若观察液面仰视,多加了水,会超出刻度线造成所配制的溶液浓度偏低,
故答案为:偏低.
故答案为:取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量;
(2)除钙离子加入碳酸钠转化为沉淀,Ca2++CO32-=CaCO3↓,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,Ba2++CO32-=BaCO3↓,
故答案为:Ca2++CO32-=Ca CO3↓;Ba2++CO32-=Ba CO3↓;
(3)粗盐提纯的步骤是溶解、过滤、蒸发、结晶,由步骤可推测用的仪器是铁架台、漏斗、烧杯、玻璃棒、蒸发皿和酒精灯,
故答案为:蒸发皿;
(4)①根据实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签的实验操作步骤可知,正确的存在顺序为B E A G C G D F H,
故答案为:C;
②容量瓶配制溶液定容时,误差分析依据刻度丁液面分析判断,若观察液面仰视,多加了水,会超出刻度线造成所配制的溶液浓度偏低,
故答案为:偏低.
点评:本题考查了粗盐提纯的实验方法,关键是除杂试剂的加入顺序判断,容量瓶的使用方法和误差分析,题目综合性较强,但题目难度不大.

练习册系列答案
相关题目


 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):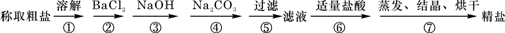

 aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液
aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液