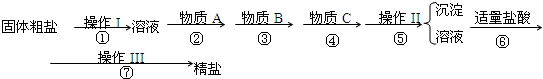
题目内容
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
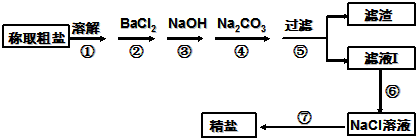
请回答:
(1)步骤⑦需采用的主要物质分离提纯操作,名称是
(2)步骤③加入过量NaOH的目的是:
(3)步骤⑥需加入适量的
2- 4 |

请回答:
(1)步骤⑦需采用的主要物质分离提纯操作,名称是
蒸发
蒸发
,所需要的实验仪器和用品除铁架台、酒精灯、玻璃棒外,还要蒸发皿
蒸发皿
.(2)步骤③加入过量NaOH的目的是:
溶液中存在的Mg2+和Fe3+完全转化为沉淀除去
溶液中存在的Mg2+和Fe3+完全转化为沉淀除去
(3)步骤⑥需加入适量的
盐酸
盐酸
(填试剂名称),所发生反应的离子方程式为:OH-+H+=H2O、CO32-+2H+=H2O+CO2↑
OH-+H+=H2O、CO32-+2H+=H2O+CO2↑
.分析:(1)依据氯化钠溶解度随温度变化不大分析,用溶液蒸发结晶方法得到氯化钠,溶液蒸发需要在蒸发皿中进行;
(2)粗盐中的Ca2+、Mg2+、Fe3+、SO
以及泥沙等杂质,加入氢氧化钠溶液是沉淀Mg2+和 Fe3+;
(3)粗盐提纯用氯化钡沉淀硫酸根离子,氢氧化钠沉淀镁离子和铁离子,加入碳酸钠把过量的钡离子沉淀,过滤得到滤液中含有过量氢氧化钠、碳酸钠,需要加入适量盐酸除去.
(2)粗盐中的Ca2+、Mg2+、Fe3+、SO
2- 4 |
(3)粗盐提纯用氯化钡沉淀硫酸根离子,氢氧化钠沉淀镁离子和铁离子,加入碳酸钠把过量的钡离子沉淀,过滤得到滤液中含有过量氢氧化钠、碳酸钠,需要加入适量盐酸除去.
解答:解:(1)步骤⑦需采用的主要物质分离提纯操作是在氯化钠溶液中,通过蒸发溶剂析出氯化钠晶体,在蒸发皿中蒸发溶液,故答案为:蒸发;蒸发皿;
(2)步骤③加入过量NaOH的目的是为了完全沉淀镁离子和铁离子除去,故答案为:溶液中存在的 Mg2+和 Fe3+ 完全转化为沉淀除去;
(3)粗盐提纯用氯化钡沉淀硫酸根离子,氢氧化钠沉淀镁离子和铁离子,加入碳酸钠把过量的钡离子沉淀,过滤得到滤液中含有氯化钠、过量氢氧化钠、碳酸钠,需要加入适量盐酸到不再有气体生成证明除去氢氧化钠和碳酸钠;反应的离子方程式为:OH-+H+=H2O、CO32-+2H+=H2O+CO2↑,故答案为:盐酸;OH-+H+=H2O、CO32-+2H+=H2O+CO2↑.
(2)步骤③加入过量NaOH的目的是为了完全沉淀镁离子和铁离子除去,故答案为:溶液中存在的 Mg2+和 Fe3+ 完全转化为沉淀除去;
(3)粗盐提纯用氯化钡沉淀硫酸根离子,氢氧化钠沉淀镁离子和铁离子,加入碳酸钠把过量的钡离子沉淀,过滤得到滤液中含有氯化钠、过量氢氧化钠、碳酸钠,需要加入适量盐酸到不再有气体生成证明除去氢氧化钠和碳酸钠;反应的离子方程式为:OH-+H+=H2O、CO32-+2H+=H2O+CO2↑,故答案为:盐酸;OH-+H+=H2O、CO32-+2H+=H2O+CO2↑.
点评:本题考查了粗盐提纯的实验方法的分析判断,试剂的选择应用,注意试剂加入顺序和过量试剂的除去,题目难度中等.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
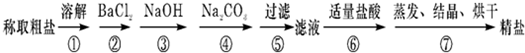
 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
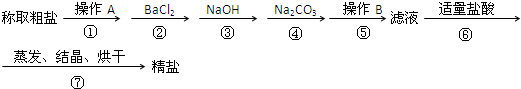
 aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液
aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液