题目内容
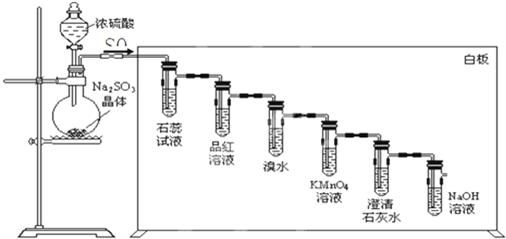
(1)写出反应生成SO2的方程式:
(2)SO2依次通入各溶液时,说明SO2是酸性氧化物的现象是
考点:二氧化硫的化学性质
专题:氧族元素
分析:(1)亚硫酸钠和硫酸反应生成二氧化硫、硫酸钠和水,强酸制取弱酸;
(2)二氧化硫与水反应生成亚硫酸,遇指示剂变色,可使石灰水变浑浊;具有漂白性使品红褪色;具有还原性,与溴水、高锰酸钾发生氧化还原反应,以此来解答.
(2)二氧化硫与水反应生成亚硫酸,遇指示剂变色,可使石灰水变浑浊;具有漂白性使品红褪色;具有还原性,与溴水、高锰酸钾发生氧化还原反应,以此来解答.
解答:
解:(1)亚硫酸钠和硫酸反应生成二氧化硫、硫酸钠和水,反应方程式为Na2SO3+H2SO4═SO2↑+H2O+Na2SO4,故答案为:Na2SO3+H2SO4═SO2↑+H2O+Na2SO4;
(2)二氧化硫与水反应生成亚硫酸,遇指示剂变色,可使石灰水变浑浊,则说明SO2是酸性氧化物的现象是石蕊试液变红、石灰水变浑浊;说明SO2具有漂白性的现象是品红褪色;说明SO2具有还原性的现象是溴水褪色、高锰酸钾溶液褪色,
故答案为:石蕊试液变红;石灰水变浑浊;品红褪色;溴水褪色;高锰酸钾溶液褪色.
(2)二氧化硫与水反应生成亚硫酸,遇指示剂变色,可使石灰水变浑浊,则说明SO2是酸性氧化物的现象是石蕊试液变红、石灰水变浑浊;说明SO2具有漂白性的现象是品红褪色;说明SO2具有还原性的现象是溴水褪色、高锰酸钾溶液褪色,
故答案为:石蕊试液变红;石灰水变浑浊;品红褪色;溴水褪色;高锰酸钾溶液褪色.
点评:本题考查二氧化硫的性质,综合考查元素化合物知识,为高频考点,把握二氧化硫的制备、漂白性、还原性为解答的关键,侧重基础知识的考查,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
下列叙述中,错误的是( )
| A、硅广泛存在自然界中,天然单质硅叫硅石 |
| B、晶体硅结构类似于金刚石,硬度也很大 |
| C、氢氟酸能和玻璃发生化学反应,所以氢氟酸要存放在塑料瓶中 |
| D、烧碱液能腐蚀玻璃并生成硅酸钠,所以烧碱液要存放在带橡胶塞的玻璃瓶中 |
下列混合物能用分液法分离的是( )
| A、酒精与乙酸 |
| B、苯和溴 |
| C、苯和水 |
| D、葡萄糖与蔗糖混合液 |
下列反应的离子方程式不正确的是( )
| A、新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O |
| B、二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C、过量的NaHSO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、在氢氧化钾的稀溶液中通少量的二氧化碳气体:CO2+2OH-═CO32-+H2O |