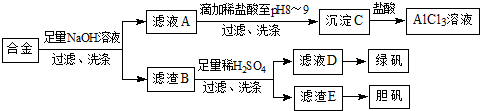
题目内容
18.盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:(1)稀盐酸不与Cu反应,若在稀盐酸中加入NaNO3溶液后,则可使铜顺利溶解.该反应的离子方程式为:Cu+H2O2+2HCl=CuCl2+2H2O.
(2)在一定体积的10mol•l-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积大于(填“大于”、“等于”或“小于”)180ml.若使剩余的铜片继续溶解,可向其中通入氧气,则该反应的化学方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(3)向氯化钡溶液中通入二氧化硫至饱和未见沉淀生成,继续通入下列气体或加入某种试剂仍无沉淀生成的是C
A.NH3 B.Cl2 C.CO2 D.HNO3E.H2S
(4)当三份Cu粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸反应后,收集到的气体在相同状况下体积相等时,三份Cu粉的质量比为A (不考虑NO2转化为N2O4和反应生成气体的溶解)
A.3:1:2 B. 3:2:2 C.1:1:2 D.2:6:3.
分析 (1)双氧水具有氧化性,在酸性环境下能将金属铜氧化;
(2)铜只能和浓硫酸反应和稀硫酸不反应,铜可以被硝酸氧化;
(3)向氯化钡溶液中通入二氧化硫至饱和未见沉淀生成,继续通入下列气体或加入某种试剂仍无沉淀,说明该物质不是碱性物质、氧化性物质、还原性物质;
(4)Cu分别与过量的稀硝酸、浓硝酸、热的浓硫酸反应生成的气体分别为NO、NO2、SO2,气体的体积再相同条件下相等,则气体物质的量相等,气体物质的量为1mol,根据电子转移守恒计算消耗Cu的物质的量;
解答 解:(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化,方程式为:Cu+H2O2+2HCl=CuCl2+2H2O,用电解原理实现铜和盐酸的反应,根据电解原理阳极必须是金属铜,电解质必须是稀盐酸,故答案为:Cu+H2O2+2HCl=CuCl2+2H2O;
(2)铜只能和浓硫酸反应和稀硫酸不反应,Cu+2H2SO4(浓)△?CuSO4+SO2↑+H2O,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则10mol•L-1的浓硫酸的实际体积要大于180mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,应为溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将同溶解,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:大于;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)向氯化钡溶液中通入二氧化硫至饱和未见沉淀生成,继续通入下列气体或加入某种试剂仍无沉淀,说明该物质不是碱性物质、氧化性物质、还原性物质,
A.NH3 通入和亚硫酸反应生成亚硫酸铵,结合氯化钡会生成沉淀,故A错误;
B.Cl2 具有氧化性能氧化二氧化硫为硫酸,结合钡离子生成硫酸钡白色沉淀,故B错误;
C.CO2 通入不能喝二氧化硫氯化钡反应,无沉淀生成,故C正确;
D.HNO3具有强氧化性,氧化二氧化硫为硫酸,结合钡离子生成硫酸钡白色沉淀,故D错误;
E.H2S和二氧化硫反应生成硫单质,溶液变浑浊,故E错误;
故选C,
故答案为:C;
(4)Cu分别与过量的稀硝酸、浓硝酸、热的浓硫酸反应生成的气体分别为NO、NO2、SO2,气体的体积再相同条件下相等,则气体物质的量相等,气体物质的量为1mol,根据电子转移守恒,则:
稀硝酸消耗Cu的物质的量为:$\frac{1mol(5-2)}{2}$=1.5mol,
浓硝酸消耗Cu的物质的量为:$\frac{1mol(5-4)}{2}$=0.5mol,
热的浓硫酸消耗Cu的物质的量为:$\frac{1mol(6-4)}{2}$=1mol,
故稀硝酸、浓硝酸、热的浓硫酸消耗Cu的物质的量之比=1.5mol:0.5mol:1mol=3:1:2,
故选A,
故答案为:A;
点评 本题考查了化学方程式有关计算,金属铜和酸反应的化学性质,氧化还原反应产物分析判断,题目综合性较强,难度中等.侧重考查解题方法与学生分析思维能力,题目利用守恒思想解答,难度中等;

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案| A. | 常温下 5mL 3mol/L的硫酸溶液 | B. | 标况下10mL 3mol/L的硫酸溶液 | ||
| C. | 标况下 20mL 2mol/L的硫酸溶液 | D. | 常温下300mL 2mol/L的硫酸溶液 |
| A. | 常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液 c(H+):①<② | |
| B. | 常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中:c(Na+)=c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-) | |
| C. | 相同条件下,pH=9的①CH3COONa溶液、②NH3•H2O溶液、③NaOH溶液中由水电离出的c(OH-):①>②>③ | |
| D. | 已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
| A. | 位置异构 | B. | 官能团异构 | C. | 顺反异构 | D. | 碳链异构 |
| A. | 向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物 | |
| B. | 将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低 | |
| C. | 向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl溶解度比Ag2S大 | |
| D. | 将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸被氧化 |
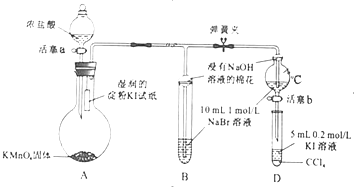
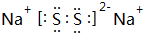 .
.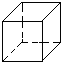 (1)相对分子质量为72的烷烃,其分子式为C5H12.若此有机物的一氯代物只有一种,请写出此烷烃的结构简式(CH3)4C.
(1)相对分子质量为72的烷烃,其分子式为C5H12.若此有机物的一氯代物只有一种,请写出此烷烃的结构简式(CH3)4C.