题目内容
实验室制取苯甲酸甲酯用苯甲酸和甲醇为原料,已知苯甲酸、甲醇、苯甲酸甲酯、浓硫酸的有关性质如下表所示:名称 | 密度/g·cm-3 | 沸点/℃ | 溶解性 |
苯甲酸 | 1.265 9 | 249 | 微溶于水、易溶于有机溶剂 |
甲醇 | 0.791 5 | 64.65 | 易溶于水、易溶于有机溶剂 |
苯甲酸甲酯 | 1.093 7 | 199 | 难溶于水、易溶于有机溶剂 |
硫酸 | 1.834 | 338 | 易溶于水 |
(1)某同学用如下图一所示的装置制备苯甲酸甲酯,结果发现锥形瓶中没有收集到苯甲酸甲酯,原因是____________________________________________________________________。

(2)该同学在分析实验失败的原因后,决定改用图二的装置进行,向烧瓶中加入浓硫酸、15 g苯甲酸、20 mL甲醇和_________________,冷却水从_________________处进。
(3)反应一段时间后,取下烧瓶,冷却后向其中加入一定量的水,分液,将分液漏斗_________________ (填“上”或“下”)层中的液体移入装有少量固体碳酸钠的锥形瓶中,过滤,碳酸钠的作用是_________________。
(4)将滤液倒入蒸馏装置中进行蒸馏,温度计应如何放置______________________________。
(5)将得到的苯甲酸甲酯进行称量,质量为13.6 g,则苯甲酸的转化率为_________________。
(1)酯化反应是一个可逆反应,反应体系中甲醇的沸点低,会先蒸发出来
(2)碎瓷片 a
(3)下 与苯甲酸反应,以除去苯甲酸
(4)水银球置于蒸馏烧瓶支管开口稍下的位置,但不与溶液接触
(5)81.3%
解析:解本题首先要弄清楚制备苯甲酸甲酯的实验原理,找到反应物的状态和反应条件。由于甲醇的沸点比苯甲酸甲酯要低得多,甲醇会首先挥发,因此采用图一的装置会失败。图二,冷凝管的作用显然是让蒸发出的甲醇回流,继续与苯甲酸反应,制得的苯甲酸甲酯与苯甲酸、甲醇、硫酸形成混合物。要使之分离,再根据溶解性,应采取分液、蒸馏的方法。通过分液,除去硫酸和甲醇,再通过与碳酸钠作用,使苯甲酸生成苯甲酸钠,然后蒸馏出苯甲酸甲酯。

某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2g 苯甲酸和20 mL 甲醇(密度约0.79g ? mL-1) ,再小心加入3 mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是_________________________________;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:_________________________________________________。
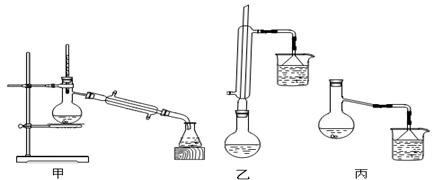
(2)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用 装置(填:甲、乙、丙)。
II. 粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为 ,操作II为 。
(4)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是
_____________________________________________________。
(5)通过计算,苯甲酸甲酯的产率为_________________________。
某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
相对分子质量 | 32 | 122 | 136 |
Ⅰ.合成苯甲酸甲酯粗产品
在烧瓶中加入12.2g 苯甲酸和20mL 甲醇(密度约0.79g/mL) ,再小心加入3mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)该反应中浓硫酸的作用?????? ,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:?????????? ,甲醇过量的原因???????????????? 。?
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是?????? 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的特点,最好采用???????? 装置(填“甲”、“乙”、“丙”)。 ?? 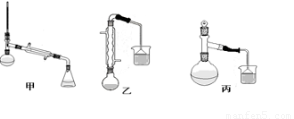
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为???? ,操作II为????? 。

(5)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是??????????????? 。
(6)苯甲酸甲酯的产率为???????? 。
某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
|
物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
|
沸点/℃ |
64.7 |
249 |
199.6 |
I. 合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g 苯甲酸和20 mL 甲醇(密度约0.79g ? mL-1) ,再小心加入3 mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是_________________________________;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:_________________________________________________。
(2)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用 装置(填:甲、乙、丙)。

II. 粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为 ,操作II为 。
(4)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是
_____________________________________________________。
(5)通过计算,苯甲酸甲酯的产率为_________________________。

