题目内容
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+ H2O H2SO3 + OH- ①
H2SO3 + OH- ①
HSO3- H+ + SO32- ②
H+ + SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
HSO3-+ H2O
 H2SO3 + OH- ①
H2SO3 + OH- ①HSO3-
 H+ + SO32- ②
H+ + SO32- ②向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
| A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 |
B.加入少量Na2SO3固体,则c(H+) + c(Na+) = c(HSO3-) + c(OH-) +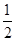 c(SO32-) c(SO32-) |
C.加入少量NaOH溶液,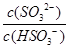 、 、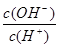 的值均增大 的值均增大 |
| D.加入氨水至中性,则2c(Na+) = c(SO32-)>c(H+) = c(OH-) |
C
NaHSO3溶液显酸性,说明HSO3-的电离程度大于其水解。A、加入的Na与水反应生成NaOH,与HSO3-反应,故c(HSO3-)减小,错误;B、该溶液中存在电荷守恒,故c(SO32-)前的系数为2,错误;C、加入少量NaOH,c(SO32-)增大,c(HSO3-)减小,c(OH-)增大,c(H+)减小,故正确;D、c(Na+)=2c(SO32-),错误。
【考点定位】考查电解质溶液,涉及弱电解质的电离和盐类的水解、三大守恒关系的应用。
【考点定位】考查电解质溶液,涉及弱电解质的电离和盐类的水解、三大守恒关系的应用。

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目

 ,该溶液中:
,该溶液中: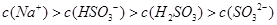
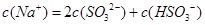
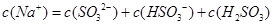
 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是