题目内容
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是_________,基态D原子价电子的轨道表达式为____________。
(2)DA2分子的VSEPR模型是____________。H2A比H2D熔沸点高得多的原因是____________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
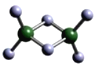
① C2Cl6属于____________晶体(填晶体类型),其中C原子的杂化轨道类型为____________杂化。
② [C(OH)4]-中存在的化学键有___________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_____________。
(5)B、C的氟化物晶格能分别是2957 kJ·mol-1、5492 kJ·mol-1,二者相差很大的原因是____________。
(6)D与E所形成化合物晶体的晶胞如图所示。
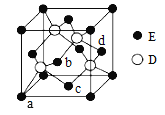
① 在该晶胞中,E的配位数为______________。
② 已知该晶胞的密度为ρ g/cm3,则其中两个D原子之间的距离为_________ pm(列出计算式即可)。
【答案】镁(或Mg)![]() 平面三角形H2O分子间存在氢键分子sp3极性共价键、配位键(或共价键、配位键)熔融MgCl2能导电,可电解;MgO熔沸点高,电解熔融MgO能耗大Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgCl2大得多4
平面三角形H2O分子间存在氢键分子sp3极性共价键、配位键(或共价键、配位键)熔融MgCl2能导电,可电解;MgO熔沸点高,电解熔融MgO能耗大Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgCl2大得多4![]()
【解析】
本题考查元素位置、结构和性质的关系,涉及元素周期律的综合应用,共价键及晶体类型的判断,晶胞等知识,正确推断元素是解本题的关键。A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3,该化合物为SO2和SO3,则A为O元素,D为S元素;工业上电解熔融氧化物(C2A3)制取单质C,则C为铝,工业上电解氧化铝制取金属铝;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区,则B为Mg元素,E为Zn元素。
(1)根据上述分析,B为Mg元素,C为Al元素,镁的最外层s轨道上有2个电子,处于全充满状态,比相邻元素的第一电离能大,则Mg、Al中第一电离能较大的是Mg;D为S元素,基态原子核外电子排布式为1s22s22p63s23p4,则基态D原子价电子的轨道表达式为![]() 。
。
(2)DA2为SO2,根据价层电子对互斥理论可知,SO2中硫原子含有的孤对电子对数是(6-2×2)÷2=1,成键电子对数为2,采用sp2杂化,则分子的VSEPR模型是平面三角形。H2A为H2O,H2D为H2S,它们均为分子晶体,但H2O分子间存在氢键,所以水的 熔沸点比H2S的熔沸点高得多。
(3)①C2Cl6是Al2Cl6,根据题意,C2Cl6 在加热时易升华,说明该分子的熔沸点较低,则Al2Cl6属于分子晶体;根据图给球棍模型可知,Al原子形成4个共价单键,则Al原子的杂化轨道类型为sp3杂化。
②[Al(OH)4]-中Al最外层有3个电子,与O原子形成三个极性共价键,Al原子还有一个空轨道,与氧原子的孤对电子形成配位键,所以[Al(OH)4]-中存在的化学键有极性共价键和配位键。
(4)熔融MgCl2能导电,可电解;MgO熔沸点高,电解熔融MgO能耗大,所以工业上制备金属Mg用电解熔融MgCl2的方法,而不是用电解熔融MgO的方法。
(5)B、C的氟化物分别为MgF2、AlF3,因为Al3+比Mg2+电荷高、半径小,所以AlF3的晶格能比MgCl2大得多 。
(6)① 根据如图所示晶胞,E原子位于顶点和面心,面心上的E原子,与它等距离最近的D原子有4个,则在该晶胞中,E的配位数为4。
②根据如图所示晶胞,晶胞中有E原子8×1/8+6×1/2=4,D原子位于四分之一晶胞中的4个小正方体的体心上,一共有4个,设该晶胞的边长为x cm, 已知该晶胞的密度为ρ g/cm3,则晶胞的边长x=![]() cm,其中两个D原子之间的距离为
cm,其中两个D原子之间的距离为![]() pm。
pm。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案