题目内容
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
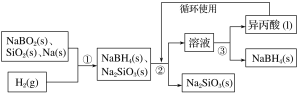
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:33 ℃)。
(1)在第①步反应加料之前,需要将反应器加热至100 ℃以上并通入氩气,该操作的目的是______________,原料中的金属钠通常保存在________中,实验室取用少量金属钠需要用到的实验用品有________、________、玻璃片和小刀等。
(2)第②步分离采用的方法是________;第③步分离(NaBH4)并回收溶剂,采用的方法是________。
【答案】排尽装置中的空气和水蒸气 煤油 镊子 滤纸 过滤 蒸馏
【解析】
(1)在第①步反应加料之前,需要将反应器加热至100 ℃以上并通入氩气,该操作的目的是排尽装置内的空气,防止钠被氧化;原料中的金属钠通常保存在煤油中;实验室取用少量金属钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀等。
(2)第②步是固体与液体分离,采用的方法是过滤;第③步分离(NaBH4)并回收溶剂,采用的方法是利用沸点的差异进行分离。
(1)Na能与空气中的水蒸气、氧气反应,NaBH4常温下能与水反应,因而通入氩气是为了排除干扰因素空气和水,取用钠时,用镊子夹取,用滤纸吸干表面的煤油。答案为:排尽装置中的空气和水蒸气;煤油;镊子;滤纸;
(2)从流程可看出第②步是固体与液体的分离,其操作为过滤。根据已知信息可知NaBH4可溶于异丙酸,且异丙酸的沸点较低(33 ℃),回收异丙酸可选用蒸馏的方法。过滤;蒸馏。

 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知 ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH= + 93.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③甲醇的燃烧热为726.51kJ·mol-1。
要写出表示甲醇燃烧热的热化学方程式,还缺少的热化学方程式为________________。
(2)甲醇可采用煤的气化、液化制取(CO+2H2CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图所示。
的关系如图所示。
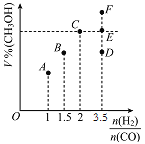
①当起始![]() =2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1molL-1min-1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是____(填标号)
=2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1molL-1min-1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是____(填标号)
A.<![]() B.=
B.=![]() C.
C.![]() ~
~ ![]() D.=
D.=![]() E.>
E.> ![]()
②当![]() =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点选填“D”、“E”或“F”)。
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点选填“D”、“E”或“F”)。
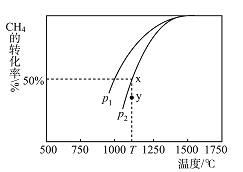
(3)制甲醇的CO和H2可用天然气来制取:CO2(g)+CH4(g)2CO(g)+2H2(g)。在某一密闭容器中有浓度均为0.1mol·L1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH______(选填“大于”“小于”或“等于”)0。压强p1_______(选填“大于”或“小于”)p2。当压强为p2时,在y点:v(正)__________(选填“大于”“小于”或“等于”)v(逆)。若p2=6Mpa,则T℃时该反应的平衡常数Kp=_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) [反应Ⅰ]。
①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最高的反应所用的催化剂是____(填“A”、“B”或“C”)。

②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应CO2(g)+H2(g)CO(g)+H2O(g)[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是_________。
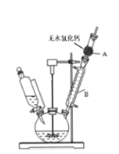
【题目】三苯甲醇(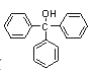 )是重要的有机合成中间体。实验室中合成三苯甲醇时采用如图所示的装置,其合成流程如图:
)是重要的有机合成中间体。实验室中合成三苯甲醇时采用如图所示的装置,其合成流程如图:
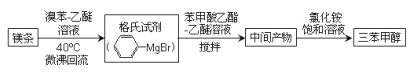
已知:①格氏试剂易潮解,生成可溶于水的 Mg(OH)Br。
②三苯甲醇可通过格氏试剂与苯甲酸乙酯按物质的量比2:1反应合成
③相关物质的物理性质如下:
物质 | 相对分子量 | 沸点 | 熔点 | 溶解性 |
三苯甲醇 | 260 | 380℃ | 164.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
乙醚 | - | 34.6℃ | -116.3℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
溴苯 | - | 156.2℃ | -30.7℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
苯甲酸乙酯 | 150 | 212.6℃ | -34.6℃ | 不溶于水 |
请回答下列问题:
(1)合成格氏试剂:实验装置如图所示,仪器A的名称是____,已知制备格氏试剂的反应剧烈放热,但实验开始时常加入一小粒碘引发反应,推测I2的作用是____。使用无水氯化钙主要是为避免发生____(用化学方程式表示)。
(2)制备三苯甲醇:通过恒压滴液漏斗往过量的格氏试剂中加入13mL苯甲酸乙酯(0.09mol)和15mL无水乙醚的混合液,反应剧烈,要控制反应速率除使用冷水浴外,还可以 ___(答一点)。回流0.5h后,加入饱和氯化铵溶液,有晶体析出。
(3)提纯:冷却后析出晶体的混合液含有乙醚、溴苯、苯甲酸乙酯和碱式溴化镁等杂质,可先通过 ___(填操作方法,下同)除去有机杂质,得到固体17.2g。再通过 ___纯化,得白色颗粒状晶体16.0g,测得熔点为164℃。
(4)本实验的产率是____(结果保留两位有效数字)。本实验需要在通风橱中进行,且不能有明火,原因是____。