题目内容
下列有关物质结构和性质的叙述正确的是:
①具有16个质子、16个中子和18个电子的微粒符号可表示为:32 16S2-;
②羟基电子式为: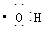 ;
;
③HClO的结构式:H—Cl—O;
④NaHCO3在水中的电离方程式:NaHCO3→Na++H++CO32-;
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化
| A.①②⑤ | B.①④⑥⑦ | C.②③④⑥ | D.②③⑤⑥⑦ |
A
解析试题分析:①具有16个质子、16个中子和18个电子的微粒符号可表示为:32 16S2-,正确; ②羟基电子式为: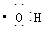 ,正确;③HClO的结构式应为:H—O—Cl; ④NaHCO3在水中的电离方程式应为:NaHCO3→Na++HCO32-,错误; ⑤Na2O的水溶液能导电,这不能说明Na2O是电解质,正确;⑥SiO2既能与氢氟酸反应不能生成盐和水,故SiO2不能是两性氧化物,错误;⑦分馏是物理变化,错误;
,正确;③HClO的结构式应为:H—O—Cl; ④NaHCO3在水中的电离方程式应为:NaHCO3→Na++HCO32-,错误; ⑤Na2O的水溶液能导电,这不能说明Na2O是电解质,正确;⑥SiO2既能与氢氟酸反应不能生成盐和水,故SiO2不能是两性氧化物,错误;⑦分馏是物理变化,错误;
考点:考查原子结构的组成,结构式的书写,电解质概念的判断,二氧化硅的性质,分馏、干馏、裂化的变化分析等。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关化学用语表述正确的是
A.质量数为16的氧原子: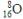 |
| B.漂白粉的有效成分:NaClO |
C.Mg2+结构示意图: 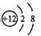 |
D.钠在氧气中燃烧的化学方程式:4Na+O2  2Na2O 2Na2O |
以NA代表阿伏加德罗常数,下列说法正确的是
| A.32g O2所含的原子数目为2NA |
| B.11.2L H2O含有的原子数目为1.5NA |
| C.1mol的Cl—含NA个电子 |
| D.0.5mol/L的NaCl溶液中Cl—的个数为是0.5NA |
标准状况下,均含有NA个电子的H2O和NH3,具有相同的
| A.质量 | B.物质的量 | C.体积 | D.氢原子数 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA |
| B.标准状况下,2.24 LNO2与水反应生成NO3-的数目为0.1NA |
| C.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA |
| D.4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA |
有关四氯化碳的化学用语正确的是
A.结构简式: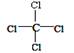 | B.电子式: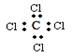 |
| C.结构简式:CCl4 | D.比例模型:  |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
| A.若M(甲)>M(乙),则气体体积:甲<乙 |
| B.若M(甲)<M(乙),则气体的压强:甲>乙 |
| C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙 |
| D.若M(甲)<M(乙),则的分子数:甲<乙 |
设NA为阿佛加德罗常数的数值,下列说法正确的是
| A.常温常压下,8gO2含有4NA个电子 |
| B.1L1mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
| C.标准状况下,22.4L盐酸含有NA个HCl分子 |
| D.1molNa被完全氧化生成Na2O2,失去2NA个电子 |
下列说法中(NA代表阿伏加德罗常数),不正确的是
| A.常温常压下,18g H2O含有的原子总数为3NA |
| B.标准状况下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| C.常温下,2.3g Na完全与O2反应失去的电子数为0.1NA |
| D.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA |