题目内容
已知蓄电池在放电时起原电池的作用,在充电时起电解池的作用。汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成。两个电极用硫酸溶液作电解质溶液。在放电时,两极发生的反应可分别表示为:Pb+![]()
![]() PbSO4+2e-
PbSO4+2e-
PbO2+4H++![]() +2e-
+2e-![]() PbSO4+2H2O
PbSO4+2H2O
充电时,两极发生的反应分别表示为:
PbSO4+2e-![]() Pb+
Pb+![]()
PbSO4+2H2O-2e-![]() PbO2+4H++
PbO2+4H++![]()
根据上述材料,回答(1)—(3)题。
(1)在放电时,下列说法正确的是( )
A.铅板为电源正极 B.铅板为电源负极
C.铅板在放电时发生氧化反应 D.铅板在放电时发生还原反应
(2)在蓄电池放电时,溶液的pH将( )
A.不变 B.升高 C.降低 D.无法确定
(3)在蓄电池生产和使用时,下列说法正确的是( )
A.生产和使用铅蓄电池时,不会造成环境污染
B.生产和使用铅蓄电池时,可能引起铅中毒和环境污染
C.使用铅蓄电池时,若铅板上有1 mol铅反应就消耗2 mol H2SO4
D.在使用时,电池内溶液的密度会增大
解析:(1)负极是金属发生氧化反应,正极是发生还原反应。(2)将放电时的两个电极反应相加可得:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O可见,放电时不断消耗H2SO4,c(H+)减小,pH升高。(3)铅的化合物会造成环境污染。硫酸的浓度越大,密度越大,所以在使用时,H2SO4溶液的浓度会逐渐降低。
2PbSO4+2H2O可见,放电时不断消耗H2SO4,c(H+)减小,pH升高。(3)铅的化合物会造成环境污染。硫酸的浓度越大,密度越大,所以在使用时,H2SO4溶液的浓度会逐渐降低。
答案:(1)BC (2)B (3)BC

练习册系列答案
相关题目
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电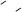 时发生的化学反应可用下式表示:
时发生的化学反应可用下式表示:
据此判断下列叙述中正确的是 ( )
A.放电时正极电极反应式PbO2 + SO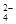 + 2e – + 4 H+= PbSO4 + 2H2O + 2e – + 4 H+= PbSO4 + 2H2O |
| B.充电时蓄电池负极应与电源正极相连接 |
| C.充电时,若要使1mol PbSO4转变为PbO2,则需要通过4mol电子 |
| D.电池放电时,溶液酸性增强 |