题目内容
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池发生反应的化学方程式可表示为:Pb+PbO2+2H2SO4(1)写出放电时负极上发生反应的化学方程式_____________________________。
(2)当蓄电池作为电源电解CuSO4溶液生成1.6 g Cu时,蓄电池内消耗H2SO4____________mol。
(3)给蓄电池充电时,若要使3.03 g PbSO4转变为Pb和PbO2,需要____________ mol的电荷量。
解析:此题涉及蓄电池的电化学原理,电解CuSO4溶液的反应原理,电极反应和有关电池、电解反应的计算等知识点。考查学生的分析能力、计算能力以及思维的严密性和整体性。
解题的关键在于:①弄清蓄电池以及电解CuSO4溶液的反应原理;②把握住电池反应与电解反应中转移的电子数相等这一恒等关系。
(1)蓄电池放电时,发生原电池反应
负极上的反应是Pb-2e-+SO![]() ====PbSO4
====PbSO4
(2)由电池反应有:2e-~2H2SO4的关系;又由电解反应2CuSO4+2H2O![]() 2Cu↓+2H2SO4+O2↑,有4e-~2Cu的关系。可得2H2SO4~Cu~2e-的关系,电解CuSO4溶液生成的Cu的物质的量为
2Cu↓+2H2SO4+O2↑,有4e-~2Cu的关系。可得2H2SO4~Cu~2e-的关系,电解CuSO4溶液生成的Cu的物质的量为![]() =0.025 mol。
=0.025 mol。
故蓄电池中消耗H2SO4的物质的量为2×0.025 mol=0.05 mol。
(3)蓄电池充电时发生电解反应![]() 有2e-~Pb~PbO2~2PbSO4的关系,即有e-~PbSO4的关系。
有2e-~Pb~PbO2~2PbSO4的关系,即有e-~PbSO4的关系。
3.03 g PbSO4的物质的量为3.03 g/303 g·mol-1=0.01 mol,转变为Pb和PbO2需转移e-的量为0.01 mol。
答案:(1)Pb-2e-+SO![]() ====PbSO4 (2)0.05 mol (3)0.01 mol
====PbSO4 (2)0.05 mol (3)0.01 mol

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电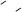 时发生的化学反应可用下式表示:
时发生的化学反应可用下式表示:
据此判断下列叙述中正确的是 ( )
A.放电时正极电极反应式PbO2 + SO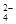 + 2e – + 4 H+= PbSO4 + 2H2O + 2e – + 4 H+= PbSO4 + 2H2O |
| B.充电时蓄电池负极应与电源正极相连接 |
| C.充电时,若要使1mol PbSO4转变为PbO2,则需要通过4mol电子 |
| D.电池放电时,溶液酸性增强 |